
分析 ①标准状况下,H2O不是气体;
②标准状况即0℃、101KP时,气体摩尔体积为22.4L/mol;
③在同温同体积时,气体压强与物质的量成正比;
④两种物质不一定都是气体;
⑤相同条件下,气体摩尔体积为常数;
⑥同温同压下,气体的密度之比等于摩尔质量之比,也等于相对分子质量之比.
解答 解:①标准状况下,HCl为气体,而H2O不是气体,二者体积相等,它们物质的量不相等,故错误;
②标况即0℃、101KP时,气体摩尔体积为22.4L/mol,故通常状况下,由于温度高于0℃,故气体摩尔体积大于22.4L/mol,故正确;
③在同温同体积时,气体压强与物质的量成正比,所以在同温同体积时,气体物质的物质的量越大,则压强越大,正确;
④标况下,两种物质不一定都是气体,它们物质的量相等,占有的体积不一定相等,故错误;
⑤相同条件下,气体物质的量越大,气体的体积越大,但是气体摩尔体积为常数,故错误;
⑥同温同压下,气体的密度之比等于摩尔质量之比,也等于相对分子质量之比,即气体的密度与气体的相对分子质量成正比,故正确.
故答案为:②③⑥.
点评 本题考查阿伏伽德罗定律及其推论,注意根据PV=nRT理解阿伏伽德罗定律及其推论、温度及压强对气体摩尔体积的影响,难度中等.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:解答题
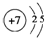 .
.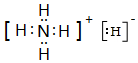 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加澄清的石灰水 | B. | 两者分别与同浓度的稀盐酸反应 | ||
| C. | 溶于水,比较其溶解性 | D. | 两者分别加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
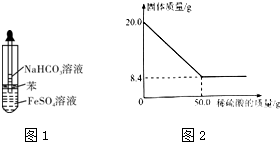
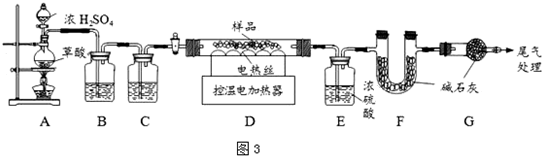
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和水反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸氢钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 工业上电解饱和食盐水的反应:2Na++2Cl-$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
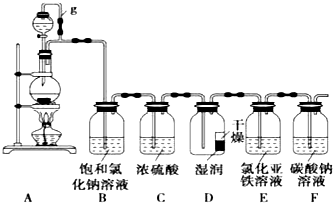 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
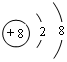 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式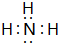 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
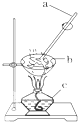 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.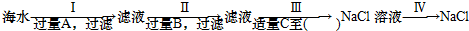
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com