
| A. | 砷的外围电子排布式:3d104S24p3 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: | |
| D. | 过氧化钠的电子式: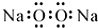 |
分析 A.As最外层含有5个电子,外围电子为4s24p3;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.氯离子的核外电子总数为18,最外层达到8电子稳定结构;
D.过氧化钠为离子化合物,电子式中阴阳离子需要标出所带电荷.
解答 解:A.As为ⅤA族元素,最外层含有5个电子,其外围电子排布式为:4s24p3,故A错误;
B.质子数为35、中子数为45的溴原子的质量数为80,该原子的表示方法为:${\;}_{35}^{80}$Br,故B正确;
C. 为硫原子结构示意图,氯离子的最外层含有8个电子,硫离子正确的离子结构示意图为:
为硫原子结构示意图,氯离子的最外层含有8个电子,硫离子正确的离子结构示意图为: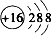 ,故C错误;
,故C错误;
D.过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,正确的电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、元素符号、电子排布式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).
实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、 碱石灰、Cu、Zn、Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
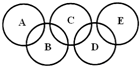 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: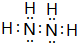 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.
;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
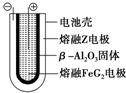 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X只有一种原子轨道,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. Fe+2ZG
Fe+2ZG查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上有5个电子的X原子与原子核外N层上有5个电子的Y原子 | |
| C. | 2p轨道上有一个未成对电子的X原子与3p轨道上有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
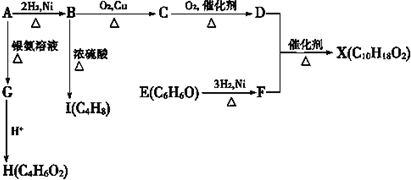
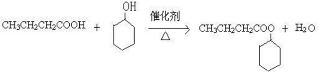 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com