


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:阅读理解
 I2+O2+H2O
I2+O2+H2O I2+O2+H2O
I2+O2+H2O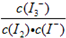
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
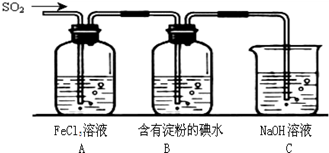
查看答案和解析>>
科目:高中化学 来源: 题型:
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究. ks5u
 (1)O3将I-氧化成I2的过程由3步反应组成:
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq) ![]() HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) ![]() I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为__ ____,其反应△H=___ ___
(2)在溶液中存在化学平衡:I2(aq) + I-(aq) ![]() I3-(aq),其平衡常数表达式为_______.
I3-(aq),其平衡常数表达式为_______.
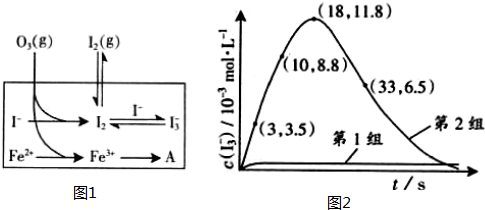
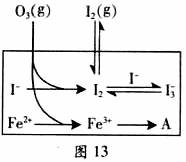
 (3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
(3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。

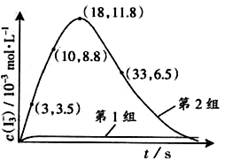
图14
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是____ ___.
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C. I2(g)不断生成 D. c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com