
(16分)(1)写出下图中序号①~④仪器的名称:

① ;② ;③ ;④ ;
(2)仪器①~④中,使用前必须检漏的 。(填仪器序号)
(3)分离碘水中的碘应在 (填装置序号)进行 和 操作。
(4)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5 mol/L的稀硫酸100mL。
①所需仪器除烧杯、玻璃棒外还需 __________、__________、__________。
②所取浓硫酸的体积为____________mL。
③下列操作引起所配溶液浓度偏高的是
A.用量筒取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤量筒,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D.定容时仰视
E. 颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
④本实验最费时间的是将稀释后的硫酸冷却至室温,为节省时间,简单易行的加快稀硫酸冷却的方法是_______________________________________.
(1)①蒸馏烧瓶② 冷凝管③分液漏斗④容量瓶(2) ③④ (3)II 萃取 分液(4)①100mL容量瓶、胶头滴管、量筒②2.7mL ③BC ④将烧杯置于冷水中
【解析】
试题分析:(1)①、②、③、④四种仪器分别是:蒸馏烧瓶、冷凝管 、分液漏斗、容量瓶(2)分液漏斗和容量瓶使用前需要检查是否漏水。(3)分离碘水中的碘先要进行萃取,用萃取剂把碘从水溶液中萃取出来,分层后进行分液,萃取实验使用装置II。(4)配制一定物质的量浓度溶液时还需要用到容量瓶、胶头滴管、量筒,容量瓶要有规格。②根据公式c=1000ρω/M=1000×1.84g/cm3×98%÷98g/mol=18.4mol/L,根据稀释公式c1V1=c2V2 ,有18.4mol/L×V1=0.5 mol/L×100mL,V1=2.7mol。③“用量筒取浓硫酸时俯视”造成量取的浓硫酸体积减小,配制浓度偏小;量筒量取溶液后是不需要洗涤的,洗涤后使得浓硫酸体积增大,配置出来的浓度偏大;.由于浓硫酸稀释放热,温度升高,在烧杯中稀释浓硫酸后,立即转移,没有冷却到室温,溶液还是热的,等配制好冷却后体积会减少,造成浓度偏大;“定容时仰视”会造成溶液的体积变大,浓度偏小;“颠倒摇匀后发现液面低于刻度线,但未加水至刻度线”对浓度没有影响。选BC。
考点:常见的仪器的认识和选择、一定物质的量浓度溶液的配制。


科目:高中化学 来源:2014-2015学年广东省汕头市高二上学期期中化学(文)试卷(解析版) 题型:?????
下列说法不正确的是
A.大米富含淀粉
B.加碘食盐含有碘酸钾
C.人体必需的微量元素就是维生素
D.人体必需的微量元素不都是金属元素
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高二上学期期中化学(文)试卷(解析版) 题型:?????
化学与生活息息相关。下列叙述正确的是
A.鲜榨橙汁遇碘水会变蓝 B.馒头越嚼越甜
C.油脂经水解可变成葡萄糖 D.土豆中的淀粉经水解可变成酒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高二上学期期中化学(理)试卷(解析版) 题型:选择题
灰锡(以粉末状存在)和白锡(韧性很好)是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰) 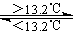 Sn(s、白) △H3=+2.1kJ·mol-1
Sn(s、白) △H3=+2.1kJ·mol-1
下列说法正确的是
A、△H1>△H2
B、锡的两种同素异形体在常温下可以相互转化,是可逆反应
C、灰锡转化为白锡的反应是吸热反应
D、锡制器皿应置于高于13.2℃的环境中,否则会自行毁坏
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列有关热化学方程式的叙述正确的是
A、已知2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为285.8 kJ·mol-1
B、已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C、含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
D、已知2C(s)+2O2(g)=2CO2(g) ΔH1 ; 2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省武威市高一上学期期中化学试卷(解析版) 题型:填空题
在标准状况下1.7g氨气所占的体积为 ,它与同条件下 mol H2S含有相同的氢原子。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省武威市高一上学期期中化学试卷(解析版) 题型:选择题
下列溶液中溶质的物质的量浓度为1 mol/L的是
A.将40 g NaOH溶解于1 L水中配成NaOH溶液
B.常温常压下将22.4 L HCl 气体溶于水配成1 L的盐酸溶液
C.将1 L 10 mol/L的浓盐酸与9L水混合配成溶液
D.从1000 mL 1 mol/L NaCl溶液中取出100 mL的溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省武威市高二上学期期中化学(理)试卷(解析版) 题型:选择题
HA为酸性略强于醋酸的一元弱酸.在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+c(H+)=c(A-)+c(OH-) D.c(Na+)+c(OH-)=c(A-)+c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高一上学期第二次阶段测试化学试卷(解析版) 题型:填空题
(14分)某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
检测次数 | 溶液中检测出的物质 |
第一次 | KCl、K2SO4、Na2CO3、NaCl |
第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
第三次 | Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第 次检测结果不正确。
(2)检测时,为了确定溶液中是否存在SO42-和CO32-:
第一,向溶液滴加 溶液(填化学式),其目的是 。
第二,继续加入过量的该溶液,其目的是 。
第三,再向溶液中加入 溶液(填化学式),确定 离子的存在,其离子反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com