I.(1)将铜粉投入盛有稀硫酸的容器中,无反应.向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,说明溶液中含有硫酸铜,即铜和氧气、硫酸反应生成硫酸铜和水,反应方程式为2Cu+O
2+2H
2SO
4=2CuSO
4+2H
2O;
铜、铂丝和氧气、稀硫酸构成原电池,加快了化学反应速率,负极上铜失电子,正极上氧气得电子和氢离子反应生成水;
从溶液中制取晶体的方法是采用蒸发、冷却结晶、过滤、洗涤的方法,
故答案为:2Cu+O
2+2H
2SO
4=2CuSO
4+2H
2O;形成了原电池;加热蒸发、冷却结晶、过滤并洗涤晶体;
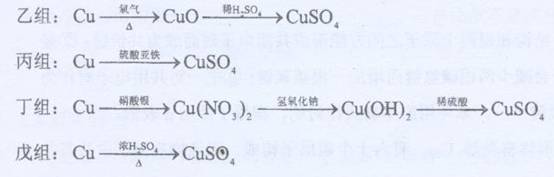
(2)乙中Cu和氧气反应需要加热,消耗能量;
丙中铜不能与硫酸亚铁反应,方案错误;
丁中铜和硝酸银反应制取硝酸铜,硝酸银的价格较高,所以耗资大;
戊中铜和浓硫酸反应需要 加热消耗能量高,且反应过程中生成的二氧化硫有毒,有污染;
根据可持续发展的原则可知最佳方案为甲,
故答案为:丙;戊;乙;甲;
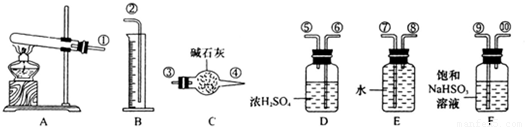
Ⅱ、(1)加热硫酸铜生成氧化铜、三氧化硫、二氧化硫和氧气,三氧化硫易溶于水生成硫酸,硫酸能和亚硫酸氢钠反应生成二氧化硫,所以亚硫酸氢钠的作用是吸收SO
3,放出等物质的量的SO
2,
故答案为:吸收SO
3,放出等物质的量的SO
2;
(2)气体通过D装置后还剩二氧化硫和氧气、水蒸气,水蒸气能影响实验的测定,所以必须通过干燥剂吸收水分,所以浓硫酸的作用是:吸收水分,干燥SO
2和O
2,
故答案为:吸收水分,干燥SO
2和O
2;
(3)测定气体体积时,应装置内气体的温度应恢复到室温,调节量筒使其液面与E装置中的液面持平,由于量筒中液面是凹液面,所以读量筒中液体体积时,视线与液体的凹液面相平,否则会造成误差,
故答案为:②调节量筒使其液面与E装置中的液面持平;③读曲量筒中液体体积时,视线与液体的凹液面相平;
(4)干燥管C吸收的物质是二氧化硫,二氧化硫包括解热硫酸铜生成的二氧化硫和三氧化硫和水、亚硫酸氢钠反应生成的二氧化硫,二氧化硫的物质的量是
=0.0375mol,根据三氧化硫和亚硫酸氢钠之间的关系式知,三氧化硫和亚硫酸氢钠反应生成的二氧化硫和三氧化硫的物质的量相等,所以三氧化硫和原生成的二氧化硫的物质的量之和是0.0375mol;测得量筒B中水的体积,得出气体在标准状况下的体积为280mL,该气体是氧气,其物质的量是
=0.0125mol,根据氧化还原反应中得失电子数相等知,原生成的二氧化硫的物质的量=
=0.025mol,所以生成的三氧化硫的物质的量是0.0375mol-0.025mol=0.0125mol;6g无水CuSO
4的物质的量=
=0.0375mol,根据铜原子守恒知,生成氧化铜的物质的量是0.0375mol,所以n(CuSO
4):n(CuO):n(SO
2):n(SO
3):n(O
2)=0.0375mol:0.0375mol:0.025mol:0.0125mol:0.0125mol=3:3:2:1:1,所以其分解方程式为3CuSO
43CuO+2SO
2↑+SO
3↑+O
2↑,
故答案为:3CuSO
43CuO+2SO
2↑+SO
3↑+O
2↑.



 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
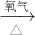 CuO
CuO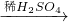 CuSO4
CuSO4 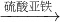 CuSO4
CuSO4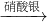 Cu(NO3)2
Cu(NO3)2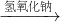 Cu(OH)2
Cu(OH)2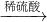 CuSO4
CuSO4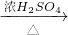 CuSO4
CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示: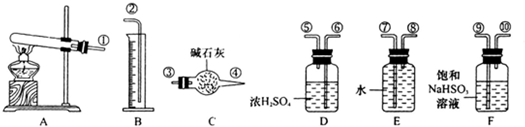

 ,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示
,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示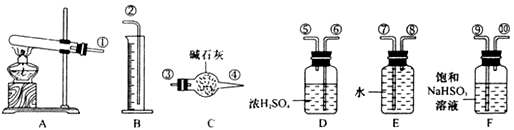
 CuO
CuO CuSO4
CuSO4  CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2 Cu(OH)2
Cu(OH)2 CuSO4
CuSO4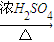 CuSO4
CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计试验测定反应生成的SO2、SO3和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.试验可能用到的仪器如下图所示: