
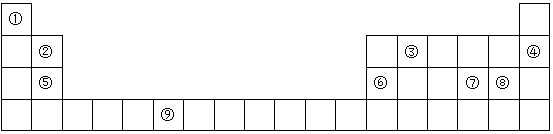
分析 由元素在周期表中的位置可知,①为氢元素,②为铍元素,③为碳元素,④为氖元素,⑤为镁元素,⑥为铝元素,⑦为硫元素,⑧为氯元素,⑨为Cr元素,
(1)Cr是24号元素,根据核外电子排布规律书写其价电子排布式;
(2)表中元素最外电子层上p电子数比s电子数少1,则外围电子排布式为ns2np1,处于第ⅢA族;
(3)同周期自左而右,第一电离能增大,同主族自上而下,第一电离能降低,能级为全满、半满、全空稳定状态,能量较低,第一电离能高于同周期相邻元素;
(4)元素的价电子排布式为nsnnpn+1,s能级容纳2个电子,故该元素的价电子排布式为2s22p3,为氮元素;
(5)元素①③形成的相对分子质量最小的分子为CH4,按原子轨道的重叠方式共价键分为σ键、π键,单键为σ键;元素⑤和⑧形成的化合物是MgCl2,属于离子化合物.
解答 解:由元素在周期表中的位置可知,①为氢元素,②为铍元素,③为碳元素,④为氖元素,⑤为镁元素,⑥为铝元素,⑦为硫元素,⑧为氯元素,⑨为Cr元素,
(1)⑨为Cr元素,Cr所含质子数为24,原子核外电子数为24,3d能级上的原子轨道处于半满时,能量较低,其核外电子排布式为[Ar]3d54s1,3d54s1,
故答案为:3d54s1;
(2)表中元素最外电子层上p电子数比s电子数少1,则外围电子排布式为ns2np1,处于第ⅢA族,为Al元素,
故答案为:Al;
(3)同周期自左而右,第一电离能增大,所以Ne>Be,⑤为镁元素,s能级为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故Mg>Al,同主族自上而下,第一电离能降低,故Be>Mg,所以第一电离能大到小的顺序为:Ne>Be>Mg>Al,即④②⑤⑥,
故答案为:④②⑤⑥;
(4)元素的价电子排布式为nsnnpn+1,s能级容纳2个电子,故该元素的价电子排布式为2s22p3,为氮元素,氮元素与氢元素形成的气态化合物分子为NH3,空间构型为三角锥型,
故答案为:三角锥型;
(5)元素①③形成的相对分子质量最小的分子为CH4,分子存在C-H单键,单键为σ键;元素⑤和⑧形成的化合物是MgCl2,氯化镁属于离子化合物,其形成晶体为离子晶体,
故答案为:σ;离子晶体.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,涉及元素周期表的结构、元素周期律、分子结构、核外电子排布规律等知识,注意掌握原子结构与元素周期律、元素周期表的关系,(3)中注意同周期第一电离能的特殊性.


科目:高中化学 来源: 题型:选择题

| A. | (1)(3) | B. | (2)(4) | C. | (4) | D. | (4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
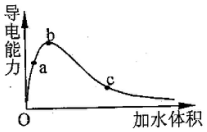
| A. | a,b,c三点溶液的pH:a>b>c | |
| B. | 若用湿润的pH试纸测试c处溶液的pH,比实际的pH偏小 | |
| C. | a,b,c三点溶液用1mol•L-1的NaOH溶液中和,消耗NaOH溶液的体积a>b>c | |
| D. | a,b,c点醋酸的电离程度:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

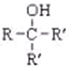
 .写出同时满足下列条件的B的同分异构体的结构简式
.写出同时满足下列条件的B的同分异构体的结构简式 .
. ,该转化中涉及到反应类型为消去反应;该反应的副产物中与D 互为同分异构体的化合物的结构简式为
,该转化中涉及到反应类型为消去反应;该反应的副产物中与D 互为同分异构体的化合物的结构简式为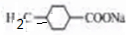 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| B. | 按系统命名法, 的名称为4,4-二甲基-3-乙基己烷 的名称为4,4-二甲基-3-乙基己烷 | |
| C. | 满足分子式为C4H8ClBr的有机物有11种 | |
| D. | 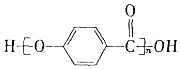 的结构中含有酯基 的结构中含有酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 英国科学家发明的尿素微生物电池的反应为:2CO(NH2)2+3O2═2CO2+2N2+4H2O,电池装置如图所示.下列说法正确的是( )
英国科学家发明的尿素微生物电池的反应为:2CO(NH2)2+3O2═2CO2+2N2+4H2O,电池装置如图所示.下列说法正确的是( )| A. | 该装置能够在高温下工作 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 装置工作时,电能转变为化学能 | |
| D. | 装置工作时,电子由电极a沿导线流向电极b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com