
【题目】A是日常生活中最常见的金属,其转化关系如图(部分反应物或生成物已略去)。
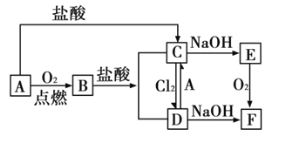
(1)写出![]() 的化学式_____________;溶液
的化学式_____________;溶液![]() 的颜色是______________。
的颜色是______________。
(2)写出下列转化的离子方程式:
①![]() :_________________。
:_________________。
②![]() :__________________。
:__________________。
(3)![]() 转化为
转化为![]() 过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:________________。
过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:________________。
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.0.1 mol C3H6Cl2中化学键总数为![]()
B.42 g乙烯中含碳原子数为3![]()
C.标准状况下,1L苯完全燃烧生成的气态产物的分子数为(6/22.4)![]()
D.0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对![]() 羟基苯甲酸乙酯。
羟基苯甲酸乙酯。
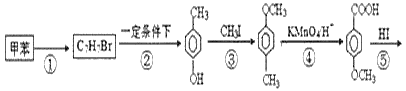
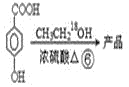
请回答:
(1)有机物C7H7Br的名称为___。
(2)产品的摩尔质量为___。
(3)在①~⑥的反应中属于取代反应的有___。
(4)![]() 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)___。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)___。
(5)![]() 的同分异构体很多,其中符合下列条件有___种。
的同分异构体很多,其中符合下列条件有___种。
①遇到FeCl3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
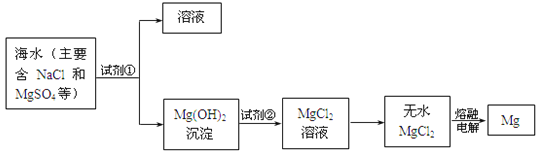
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用_________;
(2)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为__________________;
(3)电解后产生的副产物氯气可用于工业制漂白粉。某兴趣小组模拟工业制漂白粉,设计了下图的实验装置。
已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
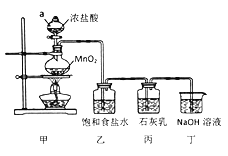
回答下列问题:
①甲装置中仪器a的名称是____________________;
②装置乙中饱和食盐水的作用是__________________________________;
③制取漂白粉的化学方程式是_____________________________________;
④该小组制得的漂白粉中n(CaCl2)远大于n(Ca(ClO)2],其主要原因是_________;
⑤为提高丙中Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)表中元素原子半径最大的原子共占据的轨道数是_________个,Y最外层电子排布式为________,Z原子核外有_____种能量不同的电子。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
从原子结构的角度去解释Y元素的非金属性比S元素的非金属性强的原因:_______
(3)CO2的沸点_________CS2(填“>”或“<”或“=”),原因是_________________
(4)如果向BaCl2溶液中通入足量CO2气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用电离平衡移动原理解释上述现象。________
(5)过量的CO2通入NaOH溶液中,得到NaHCO3,在0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)=________其中有关碳微粒的关系为:___________ = 0.1mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年4月23日,中国人民海军成立69周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。镍铬钢抗腐蚀性能强,可用于建造航母。
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷(结构如图甲所示)。基态Cr原子的价电子排布式为_____________,基态Si原子电子占据最高能级的电子云轮廓图为_____________形,元素C、O、F的电负性由大到小的顺序为_____________。

(2)海洋是元素的摇篮,海水中含有大量F、Cl、Br、I元素。
①OF2的空间构型为_____________,其中O原子杂化方式为_____________杂化。
②KCl晶体中存在的化学键类型有_____________;CaCl2熔点要比KCl的熔点高很多,主要原因为____________________________________________________________________。
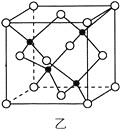
(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶胞结构如图乙所示(黑球表示Zn2+,白球表示S2-),Zn2+的配位数为_____________。晶胞边长为a nm、ZnS相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物(a)![]() 的说法错误的是
的说法错误的是
A.a、b、c的分子式均为C8H8
B.b的所有原子可能处于同一平面
C.c的二氯代物有4种
D.a、b、c均能使溴水和酸性KMnO4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com