
 CH3CH2OH(g)+3H2O(g) ΔH1
CH3CH2OH(g)+3H2O(g) ΔH1 CO(g)+3H2(g) ΔH2
CO(g)+3H2(g) ΔH2| A.增大压强 | B.加催化剂 | C.增大CO2的浓度 | D.及时分离体系中的乙醇 |
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3 H1、
H1、 H3表示)。
H3表示)。
 H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。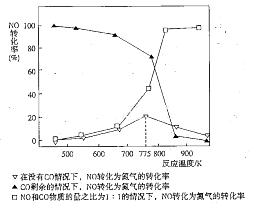
 2CO+3H2O ;2C5H12+11O2
2CO+3H2O ;2C5H12+11O2 10CO+12H2O N2+O2
10CO+12H2O N2+O2 2NO
2NO 2CO+3H2O 2C5H12+11O2
2CO+3H2O 2C5H12+11O2 10CO+12H2O在气缸内产生NO的方程式为:N2+O2
10CO+12H2O在气缸内产生NO的方程式为:N2+O2 2NO。(2)反应(i)的正反应为气体体积减小的反应。所以要提高氢气转化率可以通过增大反应物CO2的浓度、减小生成物乙醇的浓度或增大压强等措施来实现。由于催化剂能同等倍数的改变正反应、逆反应的速率,所以平衡不发生移动。乙醇选项为ACD。(3)①+③×2,整理可得:2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g) ΔH1+2ΔH3。(4)由图像可以看出:升高温度,化学平衡常数增大。即:升高温度,化学平衡向正反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。正反应方向为吸热反应。所以反应(ii)的焓变ΔH2>0。对于反应(ⅱ)在反应开始时,c(CH4)=1mol/L;c(H2O)="1mol/L." c(CO)= c(H2)=0.当反应达到平衡时,c(CH4)=" 0.5" mol/L;c(H2O)=" 0.5" mol/L, c(CO)=" 0.5" mol/L ;c(H2)=" 1.5" mol/L。所以化学平衡常数为:
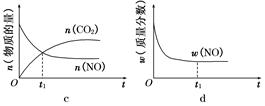
2NO。(2)反应(i)的正反应为气体体积减小的反应。所以要提高氢气转化率可以通过增大反应物CO2的浓度、减小生成物乙醇的浓度或增大压强等措施来实现。由于催化剂能同等倍数的改变正反应、逆反应的速率,所以平衡不发生移动。乙醇选项为ACD。(3)①+③×2,整理可得:2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g) ΔH1+2ΔH3。(4)由图像可以看出:升高温度,化学平衡常数增大。即:升高温度,化学平衡向正反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。正反应方向为吸热反应。所以反应(ii)的焓变ΔH2>0。对于反应(ⅱ)在反应开始时,c(CH4)=1mol/L;c(H2O)="1mol/L." c(CO)= c(H2)=0.当反应达到平衡时,c(CH4)=" 0.5" mol/L;c(H2O)=" 0.5" mol/L, c(CO)=" 0.5" mol/L ;c(H2)=" 1.5" mol/L。所以化学平衡常数为: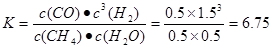 。从反应开始至达到平衡时氢气的反应速率v(H2)="Δc/Δt=1.5mol/L÷5h=0.3mol/(" L·h). (5)在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是NO分解反应是放热反应,达平衡后,温度升高,则平衡逆向移动,导致分解率降低。由图像可以看出在NO:CO=1:1时NO的转化率随温度的升高而增大。当温度在850K时NO的转化率最大。所以应控制的最佳温度为850K左右。
。从反应开始至达到平衡时氢气的反应速率v(H2)="Δc/Δt=1.5mol/L÷5h=0.3mol/(" L·h). (5)在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是NO分解反应是放热反应,达平衡后,温度升高,则平衡逆向移动,导致分解率降低。由图像可以看出在NO:CO=1:1时NO的转化率随温度的升高而增大。当温度在850K时NO的转化率最大。所以应控制的最佳温度为850K左右。

科目:高中化学 来源:不详 题型:填空题
 CO(g)+ H2(g);
CO(g)+ H2(g); CO (g)+ 3H2(g)
CO (g)+ 3H2(g)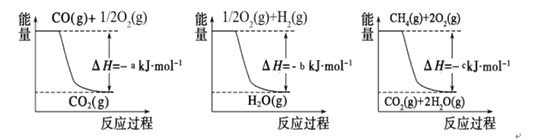
 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4PCl3(g) + a kJ, P4(s)+10Cl2(g)
4PCl3(g) + a kJ, P4(s)+10Cl2(g) 4PCl5(g) + b kJ。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ/mol,PCl3中P-Cl键的键能为1.2c kJ/mol。下列叙述正确的是
4PCl5(g) + b kJ。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ/mol,PCl3中P-Cl键的键能为1.2c kJ/mol。下列叙述正确的是| A.P-P键的键能大于P-Cl键的键能 |
B.可求Cl2(g)+PCl3(g) PCl5(s)的反应热 PCl5(s)的反应热 |
C.Cl-Cl键的键能为 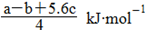 |
D.P-P键的键能为  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为: O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。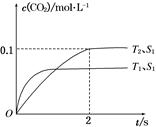

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2H2(g)+O2(g) 2H2O(l) ΔH="-285.8" kJ/mol 2H2O(l) ΔH="-285.8" kJ/mol |
B.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol |
C.CH4(g)+2O2(g) CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol CO2(g)+2H2O(g)ΔH="-890.3" kJ/mol |
D.CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol CO2(g)+2H2O(l)ΔH="+890.3" kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-252.9 kJ·mol-1 | B.+252.9 kJ·mol-1 |
| C.-604.5 kJ·mol-1 | D.+604.5 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com