
| A. | D>C>B>A | B. | B>C>D>A | C. | D>B>C>A | D. | C>D>A>B |
分析 前20号不同周期的四种元素A、B、C、D,原子序数依次递增,可形成离子化合物DA、CB、D2B,可形成共价化合物A2B、若A、D同族,则A是H,B是O,C是Mg,D是K,电子层越多,半径越大,电子层一样,质子数越多,半径越小,据此回答.
解答 解:前20号不同周期的四种元素A、B、C、D,原子序数依次递增,可形成离子化合物DA、CB、D2B,可形成共价化合物A2B、若A、D同族,则A是H,B是O,C是Mg,D是K,电子层越多,半径越大,电子层一样,质子数越多,半径越小,上述物质中有关离子半径大小顺序是:K+>O2->Mg2+>H-,故选C.
点评 本题考查结构与位置关系、离子半径比较、化学用语等,难度不大,推断元素是关键,注意基础知识的掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 无法判断混合物中是否含有Na2O | B. | 由Ⅱ可知X中一定存在SiO2 | ||
| C. | 1.92g固体成分为Cu | D. | 15.6g混合物X中m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
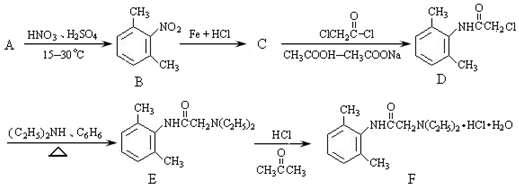
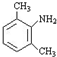 ;
;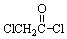 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式: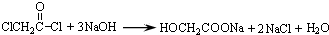 .
.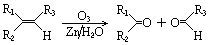
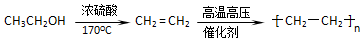
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
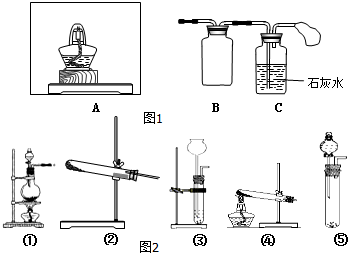 Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
| 阴离子符号 | 物质的量浓度/mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
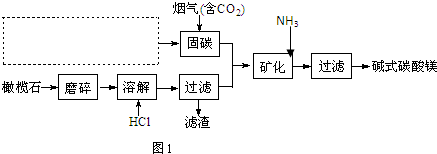
 .
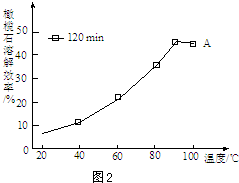
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
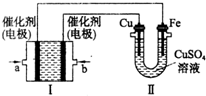 如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.
如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com