
【题目】某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象。
实验步骤 | 实验现象 |
① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
请帮助该同学整理并完成实验报告。
(1)实验目的:研究_________________元素性质递变规律。
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
实验内容 | ① | ② | ③ | ④ |
实验现象(填A~D) | _________ | ______ | _______ | ___________ |
(3)写出实验①\②对应化学方程式
实验① ______________________________________________________________________,
实验②_______________________________________________________________________。
(4)实验结论:______________________________________________。
【答案】 第三周期金属 B A D C Mg+2H2O![]() Mg(OH)2+H2↑ 2Na+2H2O=2NaOH+H2↑ 第三周期的金属性:Na>Mg>Al或:第三周期元素随着核电荷数的递增,金属性逐渐减弱
Mg(OH)2+H2↑ 2Na+2H2O=2NaOH+H2↑ 第三周期的金属性:Na>Mg>Al或:第三周期元素随着核电荷数的递增,金属性逐渐减弱
【解析】(1)由题目可知,表中的内容研究的是金属钠镁铝的性质,实验目的为探究同周期金属元素或第三周期金属性质递变规律;(2)实验内容:(2)将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,镁与热水反应生成氢气,有气泡产生,反应生成氢氧化镁,溶液呈碱性,再向溶液中滴加酚酞溶液,溶液呈红色;金属钠较活泼,放入滴有酚酞溶液的冷水中因为生成氢氧化钠而使得溶液显示红色,同时还会产生氢气,现象有:浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色;镁较铝活泼,但都能与盐酸发生置换反应,将镁条投入稀盐酸中,剧烈反应,迅速产生大量无色气体;将铝条投入稀盐酸中,反应不十分剧烈,产生无色气体。故答案为:实验内容①②③④对应的实验现象BADC。(3)镁与热水反应生成氢气、氢氧化镁, Mg+2H2O![]() Mg(OH)2+H2↑,钠和水反应生成氢氧化钠和氢气: 2Na+2H2O=2NaOH+H2↑;(4)实验结论:第三周期的金属性:Na>Mg>Al或:第三周期元素随着核电荷数的递增,金属性逐渐减弱。
Mg(OH)2+H2↑,钠和水反应生成氢氧化钠和氢气: 2Na+2H2O=2NaOH+H2↑;(4)实验结论:第三周期的金属性:Na>Mg>Al或:第三周期元素随着核电荷数的递增,金属性逐渐减弱。


科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为____(用相应的元素符号表示);氮原子的杂化轨道类型为____。
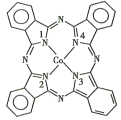
(3)Fe(CO)x,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_____(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO____FeO(填“>”“<”或“=”),原因是____________。
(5)NiAs的晶胞结构如图所示:
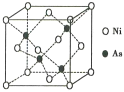
①镍离子的配位数为__________。
②若阿伏加德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为______cm。(写出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯的说法不正确的是( )
A.氯气是由瑞典化学家舍勒首先制得B.氯气是由英国化学家戴维命名的
C.氯元素主要以单质的形式大量存在海水里D.氯气是一种重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第________周期第________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是________(写化学式)。
(2)W的基态原子核外电子排布式是___________________________________。
(3)W2Y在空气中煅烧生成W2O的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Fe原子的外围电子排布图为![]()
C. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科技工作者对含有碳杂质的金属铝的腐蚀与溶液酸碱性的关系进行了研究,在25℃时得出溶液pH值对铝的腐蚀影响关系如图所示,下列说法正确的是( )

A. 金属铝在浓硫酸中的腐蚀速率大于盐酸中的腐蚀速率
B. 金属铝在中性环境中不易被腐蚀
C. 金属铝在pH=8.5的Na2CO3溶液中会发生电化学腐蚀析出氧气
D. 不能用电解的方法在金属铝的表面生成致密的氧化物薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它的爆炸反应为2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的电负性从大到小依次为________。
(2)在生成物中,A的晶体类型为________,含极性共价键的分子的中心原子轨道杂化类型为________。
(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com