
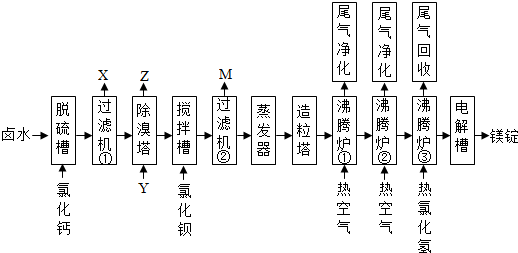
分析 卤水中含有Mg2+、Na+、Cl-、SO42-、Br-等离子,卤水中加入CaO在脱硫槽除去SO42-,生成CaSO4,经过滤机①得到X为CaSO4,经除溴塔,通入氯气,可除去Br-,生成Z为Br2,在搅拌槽中加入BaO,进一步除去SO42-,M的主要成分是BaSO4,经蒸发器、造粒塔,得到氯化镁晶体,再经沸腾炉①和②脱除氯化镁晶体中的部分水,沸腾炉③通入热的HCl气体,可防止发生水解,在电解槽中电解熔融的氯化镁,可得到镁锭,以此解答该题.
解答 解:卤水中含有Mg2+、Na+、Cl-、SO42-、Br-等离子,卤水中加入CaO在脱硫槽除去SO42-,生成CaSO4,经过滤机①得到X为CaSO4,经除溴塔,通入氯气,可除去Br-,生成Z为Br2,在搅拌槽中加入BaO,进一步除去SO42-,M的主要成分是BaSO4,经蒸发器、造粒塔,得到氯化镁晶体,再经沸腾炉①和②脱除氯化镁晶体中的部分水,沸腾炉③通入热的HCl气体,可防止发生水解,在电解槽中电解熔融的氯化镁,可得到镁锭,
(1)由以上分析可知脱硫槽、搅拌槽均用于脱除卤水中的 SO42-,M的主要成分是BaSO4,故答案为:SO42-;BaSO4;
(2)除溴塔中通入氯气,以除去Br-,反应的离子方程式为Cl2+2Br-═2Cl-+Br2,故答案为:Cl2+2Br-═2Cl-+Br2;
(3)经沸腾炉①和②脱除氯化镁晶体中的部分水,因氯化镁易水解生成氢氧化镁,则沸腾炉③通入热的HCl气体,可防止发生水解,
故答案为:脱除氯化镁晶体中的部分水;防止氯化镁晶体进一步脱水过程中发生水解;
(4)电解氯化镁生成镁和氯气,阴极发生还原反应,电极方程式为Mg2++2e-═Mg,故答案为:Mg2++2e-═Mg;
(5)阳极生成氯气,可用于除溴塔,除去溴,故答案为:氯气;除溴塔(除溴工段).
点评 本题考查物质的制备和分离,为2016年海南高考题,侧重于学生的分析、实验能力的考查,题目难度中等,注意根据物质的性质认真分析流程图的反应过程,正确判断各物质是解答该题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾有效措施 | |
| C. | 绚丽缤纷彩色的烟花中添加了含钾、钠、铁、铜等金属化合物 | |
| D. | 使用该分子催化剂可将一次能源太阳能直接转化成二次能源,例如电能、氢能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1 mol铜粉在1.12 L氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 标准状况下,22.4 L由CO和N2组成的混合气体中含有2NA个原子 | |
| C. | 一定量的浓H2SO4与0.1 mol Mg恰好完全反应,生成的SO2分子数一定为0.1NA | |
| D. | 1.6 g-NH2和1.5 g-CH3含有的电子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
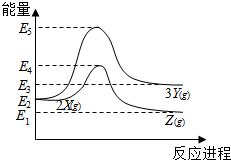
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H<0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
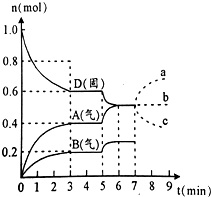 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L•min) | |
| B. | 根据如图该反应的平衡常数表达式为k=c2(A)•c(B) | |
| C. | 若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型
用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com