
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amolL-1的氨水与0.01molL-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=__。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__,溶液中离子浓度大小关系为__。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2molL-1,则该温度下pH=3、c(HSO3-)=0.1molL-1的NaHSO3溶液中c(H2SO3)=__。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__。(已知lg2=0.3)
【答案】a 中 ![]() 1.0×10-7mol/L c(NH4+)=c(CH3COO-)>c(OH-)=c(H+) 0.01mol/L 3.3≤pH<9
1.0×10-7mol/L c(NH4+)=c(CH3COO-)>c(OH-)=c(H+) 0.01mol/L 3.3≤pH<9
【解析】
(1)平衡常数只与温度有关,升高温度平衡向吸热方向移动;
(2)所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH-)═c(H+);根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3H2O的电离常数Kb=![]() ;
;
(3)CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液铵根离子和醋酸根离子水解程度相同,导致醋酸铵溶液呈中性;水的电离程度很小,据此判断离子浓度大小;
(4)根据亚硫酸第一步电离平衡常数计算亚硫酸浓度;
(5)![]() ≤c(OH-)<
≤c(OH-)<![]()
(1)a、平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,所以它们都能反映一定条件下对应变化进行的程度,故a正确;
b、升高温度平衡向吸热方向移动,如果化学平衡正反应是放热反应,则升高温度化学平衡常数减小,故b错误;
c、电离平衡常数只与温度有关,温度相同电离平衡常数相同,故c错误;
故选a;
(2)所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH-)=c(H+),溶液呈中性;根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3H2O的电离常数Kb=![]() =
=![]() =
=![]() ,故答案为:中;
,故答案为:中;![]() ;
;
(3)CH3COOH和NH3·H2O电离常数相等,则该温度下CH3COONH4溶液铵根离子和醋酸根离子水解程度相同,导致醋酸铵溶液呈中性,水电离出的氢离子浓度为1.0×10-7mol/L;水的电离程度很小,溶液中离子浓度大小顺序是c(NH4+)=c(CH3COO-)>c(OH-)=c(H+),故答案为:1.0×10-7mol/L;c(NH4+)=c(CH3COO-)>c(OH-)=c(H+);
(4)电离常数Ka=1×10-2molL-1,则该温度下pH=3、c(HSO3-)=0.1molL-1的NaHSO3溶液中c(H2SO3)=![]() =
=![]() =mol/L=0.01mol/L,故答案为:0.01mol/L;
=mol/L=0.01mol/L,故答案为:0.01mol/L;
(5)Ksp(Fe(OH)3)=c(Fe3+)c3(OH-),要使Fe3+完全沉淀,则c(Fe3+)<1.0×10-5mol/L,则c(OH-)(最小)= =
=![]() =2×10-11,求得pH=3.3;若Mg2+不沉淀,则c(OH-)(最大)=
=2×10-11,求得pH=3.3;若Mg2+不沉淀,则c(OH-)(最大)= =
=![]() =10-5,求得pH=9,则3.3≤pH<9,故答案为:3.3≤pH<9。
=10-5,求得pH=9,则3.3≤pH<9,故答案为:3.3≤pH<9。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中 不变
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→ +H2O,下列有关三聚氰胺的说法正确的是
+H2O,下列有关三聚氰胺的说法正确的是
A.分子式为C3H6N3O3
B.属于共价化合物
C.分子中既含极性键,又含非极性键
D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机反应类型的以下判断不正确的是( )
选项 | 有机反应 | 反应类型 |
A | 苯与H2反应生成环己烷 | 加成反应 |
B | 甲烷与氯气混合光照爆炸 | 取代反应 |
C | 乙烯与溴的CCl4溶液反应 | 取代反应 |
D | 乙烯使酸性高锰酸钾溶液褪色 | 氧化反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
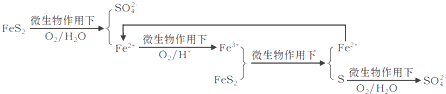
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:


按以下合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了_____气体,继续滴加至液溴滴完,装置d的作用是______。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑。
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤,NaOH溶液洗涤的作用是_____。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的目的是_____。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为_______,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母)。
A. 重结晶 B. 过滤 C. 蒸馏 D. 萃取
(4)在该实验中,a的容积最适合的是_____(填入正确选项前的字母):
A. 25 mL B.50 mL C. 250 mL D. 500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是

A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO32-水解程度增大有关
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫![]() 广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱羰基硫中的硫,其中氢解和水解反应是两种常用的脱硫方法,
广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱羰基硫中的硫,其中氢解和水解反应是两种常用的脱硫方法,
其反应式分别为:
①氢解反应:![]()
![]()
![]()
![]()
②水解反应:![]()
![]()
![]()
请回答下列问题:
(1)![]() 和
和![]() 能反应生成
能反应生成![]() 和
和![]() ,写出该反应的热化学方程式_______。
,写出该反应的热化学方程式_______。
(2)水解反应达到平衡后,若减小容器的体积,逆反应速率将______![]() 填增大、减少或不变,下同
填增大、减少或不变,下同![]() ,COS的转化率______。
,COS的转化率______。
(3)某温度下,体积为2L的恒容体系中,物质的量分别为m、n的COS蒸气和![]() 气发生氢解,已知COS的转化率为
气发生氢解,已知COS的转化率为![]() ,则该温度下的平衡常数表达式
,则该温度下的平衡常数表达式![]() ________________________
________________________![]() 用m、n、
用m、n、![]() 等符号表示
等符号表示![]() 。
。
(4)某科研小组研究改进催化剂![]() 和温度对COS水解的影响,得到如图
和温度对COS水解的影响,得到如图

COS水解的最佳温度是__________________;理由是__________________________。
(5)研究表明,用金属储氢材料![]() 、白金
、白金![]() 、硫酸溶液组成的原电池可以发生羰基的氢解而脱硫处理。写出原电池的正极反应式____________________;
、硫酸溶液组成的原电池可以发生羰基的氢解而脱硫处理。写出原电池的正极反应式____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl的沉淀溶解平衡为AgCl(s)![]() Ag+(aq)+Cl(aq),下列说法中错误的是( )
Ag+(aq)+Cl(aq),下列说法中错误的是( )
A.向AgCl悬浊液中加少量水,c(Ag+)一定减小
B.AgCl饱和溶液中c(Ag+)=![]() mol/L
mol/L
C.用NaCl溶液代替蒸馏水洗涤AgCl沉淀,可以减少沉淀损失
D.反应AgCl+NaBr=AgBr+NaCl易进行,说明溶解度:AgCl>AgBr
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com