
| 1×10-14 |
| 0.01 |
| 1×10-14 |
| 0.01 |
| (0.5-0.3)mol/L×0.1L |
| 0.1L+0.1L |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
| A、等于P% | B、大于P% |
| C、小于P% | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
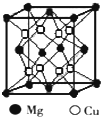 人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛.试回答下列问题.
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛.试回答下列问题.| 丁炔铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
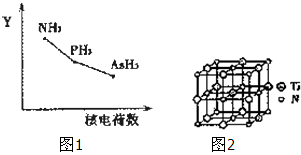 我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖.
我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
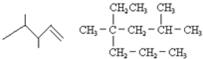
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02 mol |
| B、0.01 mol |
| C、0.04 mol |
| D、无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com