
(8分)实验室用固体烧碱配制0.1 mol /L的NaOH溶液500 mL,回答下列问题:
(1)计算需要NaOH固体的质量 g。
(2)有以下仪器和用品:①烧杯②药匙③250 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平。配制时,必须使用的仪器或用品有 (填序号),还缺少的仪器是 。
(3)使用容量瓶前必须进行的第一步操作是 。
(4)配制时,一般分为以下几个步骤:① 称量② 计算③ 溶解④ 摇匀⑤ 转移⑥ 洗涤⑦ 定容,
其正确的操作顺序为 。
(5)配制过程中,下列操作会引起结果偏高的是 (填序号)。
① 未洗涤烧杯、玻璃棒 ② NaOH溶液未冷却至室温就转移到容量瓶并定容
③ 容量瓶不干燥,含有少量蒸馏水 ④ 称量NaOH的时间太长 ⑤ 定容时俯视刻度
(1)2.0 (2)①②④⑤⑥;胶头滴管 (3)检查容量瓶是否漏水
(4)②①③⑧⑤⑥⑨⑦④ (5)②⑤
解析试题分析:(1)m=cVM=0.1mol?L-1×0.5L×40g/mol=2.0g。
(2)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般天平称量固体,把氯化镁倒入烧杯进行溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、500mL容量瓶,所以选取的仪器有①②④⑤⑥;所以还需要胶头滴管。
(3)使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水。
(4)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,所以正确的操作顺序为②①③⑧⑤⑥⑨⑦④。
(5)①未洗涤烧杯、玻璃棒,导致溶质的物质的量偏小,配制的溶液浓度偏低;②NaOH溶液未冷却至室温就转移到容量瓶,导致溶液的体积偏小,配制溶液的浓度偏高;③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液的体积无影响,所以配制的溶液浓度无影响;④称量NaOH的时间太长,氢氧化钠易潮解,导致溶质的物质的量偏小,配制溶液的浓度偏低;⑤定容时俯视刻度,导致溶液的体积偏小,所以配制溶液的浓度偏高;故选②⑤。
考点:考查一定物质的量浓度溶液的配制


科目:高中化学 来源: 题型:单选题
用nA表示阿伏加德罗常数的值。下列叙述正确的是
| A.1mol?L-1的Na2CO3溶液中所含钠离子总数为2nA |
| B.标准状况下,22.4L CH4分子中含质子总数为10nA |
| C.室温下,28g乙烯和丙烯的混合物中含有的碳原子数为nA |
| D.常温常压下,33.6L氯气与足量的铝充分反应,转移电子数为3 nA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.4.2 g丙烯中所含的共价键数目为0.6×6.02×1023 |
| B.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023 |
| C.相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 |
| D.相同物质的量OH-和CH3+含有相同数目的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温下,在18g18O2中含有NA个氧原子 |
| B.标准状况下,17g NH3所含共价键数为NA个 |
| C.标准状况下,22.4L苯的分子数约为NA个 |
| D.1mol Na2O2中含有的阴离子数目为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
浓H2SO4密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是
(1).若C=9.2则a>10 b>49% (2) 若C=9.2则a>10 b<49%
(3).若b=49则a=18.4 C<9.2 (4) 若b=49则a=18.4 C>9.2
| A.(1) (3) | B.(1) (4) | C.(2) (3) | D.(2) (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)将3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应,生成0.03 mol H2,若反应后的溶液中无Fe3+,且溶液体积不变,试求:
(1)原混合物中Fe2O3的质量为 ;
(2)原盐酸的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为 mL的容量瓶。
(2)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
| A.5 mL | B.10 mL | C.25 mL | D.50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。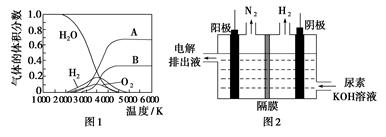
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com