
 某课外小组利用如图装置进行相关实验,请回答下列问题.
某课外小组利用如图装置进行相关实验,请回答下列问题.| 10 |
| 16 |
| ||
| ||
| ||


科目:高中化学 来源: 题型:
 某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
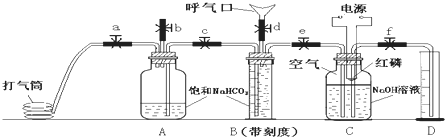
人体呼出气体中含有N2、O2、CO2、水蒸气等多种成分。某课外学习小组利用下图装置测定N2、O2、CO2、的百分含量(忽略水蒸气等微量成分)。其中B是带刻度的量气装置。
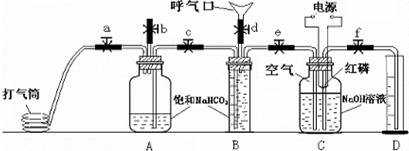
试验步骤:
①先检验装置的气密性。在向装置中装入药品(如图所示),其中C瓶溶液上方为100ml已除尽CO2的空气(N2和O2的体积比为4/1)。
②打开止水夹b、c、d,关闭止水夹e,向B瓶中吹气后关闭d,并冷却到室温,收集到V1ml气体。
③关闭b,打开止水夹a、c、e、f,用打气筒向A瓶中缓缓充气,直到B中气体刚好全部排出,此时量筒中液面读数为V2ml。
④关闭e、f,降低燃烧匙的高度,用电火花引燃红磷。
⑤等C瓶冷却到室温,打开f1最终量筒液面读数为V3ml。
回答下列问题:
(1)A、B中装饱和NaHCO3而不能装饱和Na2CO3溶液的原因是 。
(2)C装置中红磷要过量的目的是 。
(3)反应结束后,C瓶溶液中含有溶质的化学式为
(4)利用上述数据计算人体呼出气体中氧气所占体积百分数为
CO2所占体积百分数为
(5)步骤⑤中C瓶还未冷却到室温就打开止水夹读数,这样会使所测氧气体积分数 (填“偏大”或“偏小”)。
(6)严格按①~⑤进行试验后测得数据仍有一定误差,可能的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜
丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)
 Ⅱ.某课外活动小组利用如图装
Ⅱ.某课外活动小组利用如图装
置进行乙醇的催化氧化实验并制
取乙醛,图中铁架台等装置已略
去,粗黑线表示乳胶管。填写下
列空白:
(1)甲装置常常浸在70~80℃
的水浴中,目的是 。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。 乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为 。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接 、_ _接丙。
查看答案和解析>>
科目:高中化学 来源:江西省赣州十一县(市)09-10学年下学期高二期中联考 题型:实验题
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)
 Ⅱ.某课外活动小组利用如图装
Ⅱ.某课外活动小组利用如图装
置进行乙醇的催化氧化实验并制
取乙醛,图中铁架台等装置已略
去,粗黑线表示乳胶管。填写下
列空白:
(1)甲装置常常浸在70~80℃
的水浴中,目的是 。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。 乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为 。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接 、_ _接丙。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com