
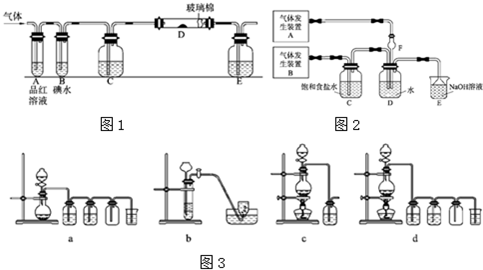
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu,稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s),浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液 | H2 | H2O |


| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
(15分)(前3空每空2分,后3空每空3分)
(1)分液漏斗
(2)3Cu + 8H++ 2NO3- = 3Cu2+ + 2NO↑+ 4H2O
(3)b A、C、D、F
(4)使量气管与干燥管两端液面相平
(5)27%
解析试题分析:(1)考查常识知识,仪器A的名称是分液漏斗。
(2)根据题中所给出的反应物和生成物书写离子方程式为3Cu + 8H++ 2NO3- = 3Cu2+ + 2NO↑+ 4H2O。
(3)氨气易溶于水,故错b。BE装置溶液发生倒吸,故错。故选ACDF。
(4)还需要注意的是要使量气管与干燥管两端液面相平。
(5)②中的属于与其它相差大,舍去不用,用①③中的数据计算,实验Ⅲ中,Mg和NaOH溶液不反应,Al与NaOH溶液反应产生H2,通过计算H2的体积为336mL, H2物质的量为0.015mol,根据2Al~3H2计算,Al的物质的量为0.01mol,Al的质量为0.27g,故镁铝合金中铝的质量分数为27%。
考点:排气量气装置 常见气体制备原理及装置选择
点评:本题考查了测定气体体积的方法,难度大,易错题是量气管中液体的选择,选择标准是和该气体不反应。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 高温 |
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试 管中滴入几滴KSCN溶液. |
|
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若置D装的是铁粉,通入Cl2与铁粉充分反应时现象为
;若装置D中装的是五氧化二钒(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②若装置B中装有5.0mL 1.0×10-3mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,该反应的化学方程式为 。
③E中盛有 溶液。
(2)某同学将足量的SO2通入一支装有氧化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2010届湖北省高三11月月考化学测试卷 题型:实验题
(10分)以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若置D装的是铁粉,通入Cl2与铁粉充分反应时现象为
;若装置D中装的是五氧化二钒(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②若装置B中装有5.0 mL 1.0×10-3mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,该反应的化学方程式为 。
③E中盛有 溶液。
(2)某同学将足量的SO2通入一支装有氧化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若置D装的是铁粉,通入Cl2与铁粉充分反应时现象为
;若装置D中装的是五氧化二钒(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②若装置B中装有5.0 mL 1.0×10-3mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,该反应的化学方程式为 。
③E中盛有 溶液。
(2)某同学将足量的SO2通入一支装有氧化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com