
| A. | MgSO4 | B. | FeCl2 | C. | AlCl3 | D. | NaAlO2 |
分析 A、硫酸镁与氢氧化钠反应生成氢氧化镁白色沉淀,氢氧化镁不能溶于氢氧化钠溶液;
B、氯化亚铁与氢氧化钠反应先生成氢氧化亚铁的白色沉淀后转变成红褐色氢氧化铁沉淀,氢氧化钠过量,氢氧化铁不溶解;
C、氯化铝与氢氧化钠反应生成氢氧化铝白色沉淀,氢氧化钠过量,溶解氢氧化铝,白色沉淀减小至消失;
D、偏铝酸钠与氢氧化钠不反应;
解答 解:A、硫酸镁与氢氧化钠反应生成氢氧化镁白色沉淀,氢氧化镁不能溶于氢氧化钠溶液,故A不符合;
B、氯化亚铁与氢氧化钠反应先生成氢氧化亚铁的白色沉淀后转变成红褐色氢氧化铁沉淀,氢氧化铁不能溶于氢氧化钠溶液,故B不符合;
C、首先发生反应AlCl3+3NaOH═Al(OH)3↓+3NaCl,生成白色沉淀,氢氧化钠过量,Al(OH)3溶于NaOH溶液,反应式为Al(OH)3+NaOH═NaAlO2+2H2O,白色沉淀逐渐溶解,故C符合;
D、偏铝酸钠与氢氧化钠不反应,故D不符合.
故选C.
点评 考查元素化合物的性质,难度不大,注意掌握理解与反应物的量、先后顺序及反应条件有关的反应.


科目:高中化学 来源: 题型:多选题
| A. | 它位于周期表的第四周期、第IA族 | |
| B. | 碳酸铷易加热分解为氧化铷和二氧化碳 | |
| C. | 铷的盐类大多易溶于水 | |
| D. | 氯化铷是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
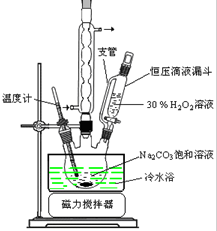 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
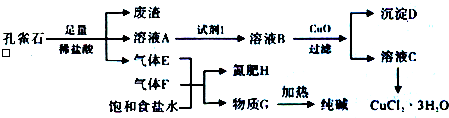
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| PH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量有关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 此反应构成的原电池中,正极可以是碳棒、铜或锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
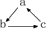 关系相互转化的是(“→”表示一步完成)( )
关系相互转化的是(“→”表示一步完成)( )| 选项 | A | B | C | D |
| a | SiO2 | NaOH | HNO3 | Cu |
| b | Na2SiO3 | Na2CO3 | NO | CuSO4 |
| c | H2SiO3 | NaHCO3 | NO2 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
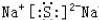 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
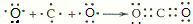 ;用电子式表示C、D两元素形成化学键的过程
;用电子式表示C、D两元素形成化学键的过程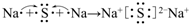 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com