
【题目】用酸性![]() 溶液进行下列实验,不能达到预期目的的是( )
溶液进行下列实验,不能达到预期目的的是( )
A.鉴别苯和甲苯
B.鉴别乙烷和乙烯
C.检验![]() 中含碳碳双键
中含碳碳双键
D.鉴别![]() 和
和![]()
科目:高中化学 来源: 题型:
【题目】我国自主知识产权的首套煤基乙醇工业化项目的生产过程:先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇涉及反应原理:
主反应:CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
副反应:CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:H2→2H*
表面反应:CH3COOCH3+4H*→CH3CH2OH*+CH3OH*
化学脱附:CH3CH2OH*→CH3CH2OHCH3OH*→CH3OH
已知:化学吸附的活化能大,决定主反应的反应速率。
(1)2CH3COOCH3(g)+2H2(g)![]() CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
(2)下列条件,有利于提高C2H5OH平衡产率的是___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)在1L密闭容器中充入1mol乙酸甲酯,乙酸甲酯的平衡转化率与温度和氢酯比(x)[x=![]() ]的关系如图1。
]的关系如图1。
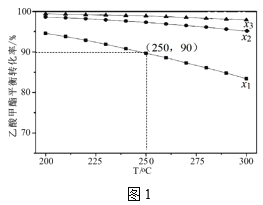
①x1、x2、x3的大小关系为___。
②250℃、x1=10,C2H5OH的选择性为60%,则主反应的平衡常数为___(保留2位有效数字)。(如乙醇选择性=![]() )
)
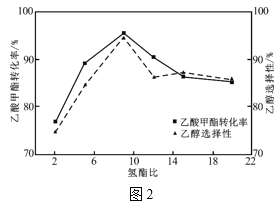
(4)其它条件相同,反应经过相同时间,乙酸甲酯的转化率与乙醇的选择性随氢酯比的关系如图2所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为___。
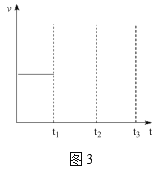
(5)若仅发生主反应,在恒压条件下,充入乙酸甲酯和氢气各2mol一段时间后达平衡,若在t1时刻再充入各1mol的反应物(其它条件不变),t2时重新达到平衡,请在图3中画出t1~t3的正逆反应速率变化的示意图。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mL Cl2,恰好将Fe2+完全氧化。下列说法正确的是( )
A. FexO溶于足量盐酸后只生成了FeCl3和H2O
B. 标准状况下112 mL Cl2的物质的量是5 mol
C. x=0.8
D. 通入Cl2后,发生反应的离子方程式:Fe2++Cl2![]() Fe3++2Cl﹣
Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜矾(主要成分 CuSO4·5H2O)是一种可用于食品添加的铜强化剂。现以某硫铁矿渣(含有 CuSO4、CuSO3、Cu2O及少量难溶于酸的Cu2S、CuS)制备铜矾的工艺过程如下:
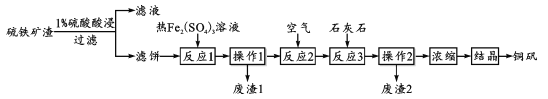
(1)“1%硫酸酸浸”时,固液质量比为1:3并进行4~6次浸取,其目的是_________;
(2)“滤饼”中含有Cu,其中Cu在“反应1”中溶解的离子方程式为________;“废渣1”中只含有S单质,则“反应1”中Cu2S与Fe2(SO4)3反应的物质的量之比为_______。
(3)“反应2”中通入空气的目的是_______;结合离子方程式,说明“反应3”加入石灰石的作用________。
(4)为了提高硫铁矿渣的利用率和产品的产率,在“浓缩”前进行的必要操作是_____;分析下列溶解度信息,最适宜的结晶方式为_________。
t/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 |
CuSO4·5H2O/(g/100g H2O) | 23.1 | 27.5 | 32.0 | 37.8 | 44.6 | 61.8 | 83.8 |
(5)将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,其有效成分为CuSO4·xCu(OH)2·yCa(OH)2。当x=1时,试确定y的值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯,乙酸正丁酯是中学化学实验中的两个重要有机实验
①乙酸乙酯的制备
②乙酸丁酯![]() 的制备
的制备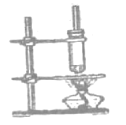
完成下列填空:
(1)制乙酸乙酯的化学方程式___________。
(2)制乙酸乙酯时,通常加入过量的乙醇,原因是________,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是________;浓硫酸用量又不能过多,原因是_______________。
(3)试管②中的溶液是________,其作用是________________。
(4)制备乙酸丁酯的过程中,直玻璃管的作用是________,试管不与石棉网直接接触的原因是_____。
(5)在乙酸丁酯制备中,下列方法可提高1-丁醇的利用率的是________(填序号)。
A.使用催化剂 B.加过量乙酸 C.不断移去产物 D.缩短反应时间
(6)两种酯的提纯过程中都需用到的关键仪器是________,在操作时要充分振荡、静置,待液体分层后先将水溶液放出,最后将所制得的酯从该仪器的________(填序号)
A.上口倒出 B.下部流出 C.都可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列说法不正确的是
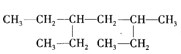
A.该有机物属于饱和链烃
B.该烃的名称是2,4-二乙基己烷
C.该烃与2,5-二甲基-3-乙基己烷互为同分异构体
D.该烃的一氯代物共有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.增大压强使平衡向生成Z的方向移动
C.在25℃下,反应的平衡常数为1600,改变温度可以改变此反应的平衡常数
D.在25℃下,测得c(X)=0.04mol·L-1,c(Y)=0.1mol·L-1,c(Z)=0.08mol·L-1,则此时v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向 100 mL 蒸馏水中滴入10 mL 5 mol·L-1HA溶液,利用传感器测得溶液中 c (H+)和温度随着加入 HA 溶液体积的变化曲线如图所示,下列有关说法正确的是
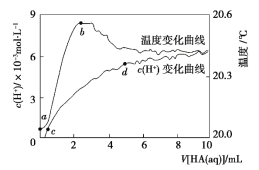
A.HA 是强酸
B.a ~ b 段,HA 电离放热,使溶液温度升高
C.c ~ d 段, c (H+)增大,HA 电离程度增大
D.c 点时,加入等体积等浓度的 NaOH 溶液,则 c (Na+)= c (A-)+ c (HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com