

| V×1000mL×1.19g?cm-3×36.5% |
| 36.5mol/L |
| 11.9Vmol |
| VL |
| m(溶质) |
| m(溶液) |
| ||
|


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:




| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |


查看答案和解析>>
科目:高中化学 来源: 题型:
- 2 |
| 3 |
| ||
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
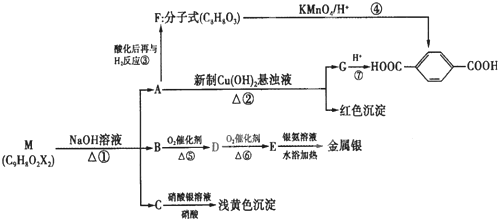
| △ |

| KMnO4 |
| H+ |










 、
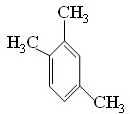
、
 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
 已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作:
已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com