

| 3.9g |
| 78g/mol |
| 0.05mol |
| 5mol/AL |
| 0.25mol |
| 5mol/L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʯ������������Һ��Ӧ |
| B���������������ᷴӦ |
| C������������Һ�����ᷴӦ |
| D������������Һ�����ᷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
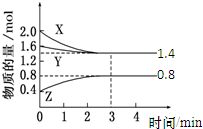 t��ʱ�����ݻ�Ϊ2L�ܱ��г���X��g����Y��g����Z��g������Ӧ������X��Y��Z�����ʵ����仯����ͼ��ʾ������˵������ȷ���ǣ�������
t��ʱ�����ݻ�Ϊ2L�ܱ��г���X��g����Y��g����Z��g������Ӧ������X��Y��Z�����ʵ����仯����ͼ��ʾ������˵������ȷ���ǣ�������| A��0��3 min��X��ƽ����Ӧ����v��X��=0.2 mol?L-1?min-1 |
| B��������Ӧ�ķ���ʽ�ɱ�ʾΪ��3X��g��+Y��g��?2Z��g�� |
| C�����������������䣬����ѹǿ��ƽ��������Ӧ�����ƶ� |
| D���¶Ȳ��䣬����X��Ũ�ȣ��÷�Ӧ��ƽ�ⳣ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | |||
| W | Y | R | |
| Z | |||
| A�����³�ѹ�£�����Ԫ�ض�Ӧ�ĵ���������������̬ |
| B��YԪ������������Ӧˮ��������Ա�WԪ�ص��� |
| C��Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ |
| D��W���⻯���X���⻯���ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ũ��/mol/L ʱ��/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����A��B��C��D��E������Һ�ֱ���HCl��NH3?H2O��NH4HSO4��NaOH��CH3COOH��
����A��B��C��D��E������Һ�ֱ���HCl��NH3?H2O��NH4HSO4��NaOH��CH3COOH��| c(B) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| �¶�/�� | 25 | T1 | t2 |
| ˮ�����ӻ����� | 1��10-14 | �� | 1��10-12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com