
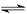 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题: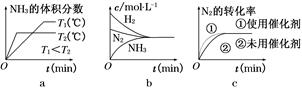
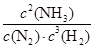 ②小
②小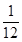 b、d
b、d 2NH3(g)ΔH=-92.4 kJ/mol,
2NH3(g)ΔH=-92.4 kJ/mol,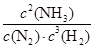 。
。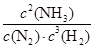 减小,K值减小。
减小,K值减小。 2NH3(g)
2NH3(g)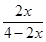 =20%,x=
=20%,x=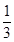 ;
;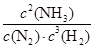 =
=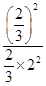 =
=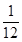 。
。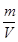 始终不变,a不能说明是否达平衡状态,
始终不变,a不能说明是否达平衡状态, ,c不能说明反应达平衡状态。
,c不能说明反应达平衡状态。

科目:高中化学 来源:不详 题型:单选题
| A.加入催化剂,X的产率增大 |
| B.升高温度,Y的转化率增大 |
| C.当容器活塞可活动时,充入稀有气体,平衡不移动 |
| D.充入Z气体时,Z的转化率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是| A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大 |
| B.升高平衡体系的温度(保持体积不变),混合气体的密度不变 |
| C.当反应达到平衡时,N2和H2的浓度比是1∶3 |
| D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 ( )
2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 ( )| A.40% | B.50% | C.60% | D.70% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2SO3至平衡。
2SO3至平衡。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示: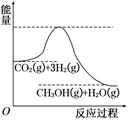
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )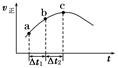
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是 | A.2v(NH3)=v(CO2) |
| B.密闭容器中c(NH3)∶c(CO2)=2∶1 |
| C.密闭容器中混合气体的密度不变 |
| D.密闭容器中氨气的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )| 温度 | 平衡浓度(mol·L-1) | |
| | c(NH3) | c(CO2) |
| T1 | 0.1 | |
| T2 | | 0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com