
【题目】下列关于氯水的说法中,不正确的是( )
A. 氯水是纯净物 B. 新制氯水显酸性
C. 新制氯水具有漂白作用 D. 新制氯水应避光保存
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素且其焰色反应为黄色.Y和W的最外层电子数相等.Y,Z两元素原子的质子数之和为W,X两元素质子数之和的3倍且Z的单质为淡黄色固体.由此可知:
(1)写出元素符号W , Z .
(2)W2X的电子式为 .
(3)由Y,X,W组成的化合物中有键和键.
(4)由W,X,Y,Z四种元素组成的化合物的化学式为 , ;写出这两种物质之间反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层电子排布图____________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为________,B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是___________;C、D和E的电负性由大到小的顺序为___________;C、D和E的第一电离能由大到小的顺序是____________;C和D最高价含氧酸的酸性由弱到强的顺序为_________________。CO![]() 中C的杂化方式为___________,该离子的“VSEPR”模型为__________________形。
中C的杂化方式为___________,该离子的“VSEPR”模型为__________________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_______,该离子的配位体为________________。
(4)D(黑球)和F(白球)形成的某种晶体的晶胞如下图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3(精确到0.1),最近的黑球和白球之间的距离为_______pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列观察目的与实验操作-致的是
观察目的 | 实验操作 | |
A | 钠的密度比水小 | 将-小块钠放入盛水的烧杯中 |
B | 钠有强还原性 | 将钠放置在煤油中 |
C | 钠有较小的硬度 | 将钠放在坩埚中加热 |
D | 钠的熔点较低 | 用小刀切开金属钠 |
A.AB.BC.CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)少量CO的存在会引起生产中催化剂中毒,常用SO2氧化CO,本身被还原为S。
已知:①C (s)+ 1/2O2(g)=CO (g)△H1=-l26.4kJ·mol-1
②C(s)+O2(g) =CO2(g)△H2=-393.5kJ·mol-1
③S(s)+O2(g)=SO2(g)△H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式__________________________。
(2) CO可用于合成甲醇,反应方程式CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
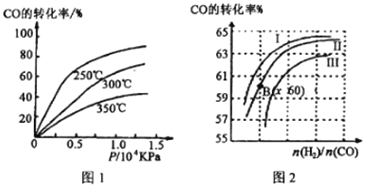
①CO转化率与温度、压强的关系如图所示,该反应△H_____________0 (填“>”或“<”)
图2中曲线I、II、III对应的平衡常数分别为K1、K2、K3,则它们的大小关系为_____________________。
②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,达到平衡时,CO与H2体积之比为2:1,则平衡常数K=_________________________。
(3)处理高浓度乙醛废水的原理:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:

①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别:
4OH--4e-=O2↑+2H2O;_________________________________。
②在实际处现过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛的含量为300mg L-1的废水,可得到乙醇_____________kg(结果保留2位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com