
| A. |  | B. | 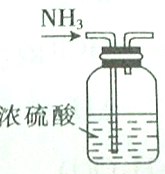 | ||
| C. | 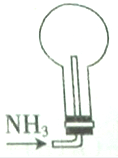 | D. |  |
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 | |
| B. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 在50℃时,pH=2的硫酸与pH=12的NaOH溶液等体积混合后,溶液的pH=7 | |
| D. | pH均等于5的HCl溶液和NH4Cl溶液中,水的电离程度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察颜色 | B. | 滴一滴硝酸在币的表面,观察现象 | ||
| C. | 用手掂量轻重 | D. | 查看图案 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaCl溶液表示的是1L溶剂中溶解0.1mol NaCl的溶液 | |
| B. | 将0.1mol氧化钠溶于水并配成1L溶液,则溶液的物质的量浓度为0.1mol•L-1 | |
| C. | 物质的量浓度和溶质质量分数均是表示溶液组成的物理量 | |
| D. | 0.1mol•L-1的CaCl2溶液中c(Cl-)也为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和HCl | B. | H2,HCl和CO | C. | CO2,CO和HCl | D. | CO2,CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | 达平衡时,途径Ⅰ所得混合气体的密度为途径Ⅱ所得混合气体密度的$\frac{1}{2}$ | |
| C. | 达平衡时,途径Ⅰ的反应速率v(A)等于途径Ⅱ的反应速率v(A) | |
| D. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的平均相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
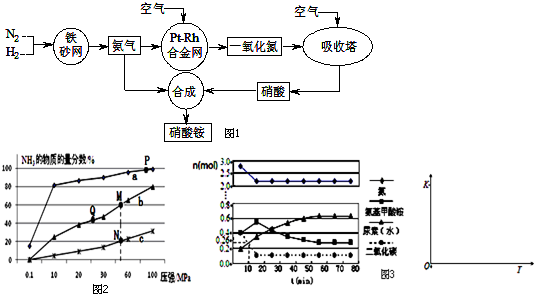
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
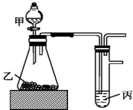 用如图装置进行实验,根据实验现象所得结论正确的是( )
用如图装置进行实验,根据实验现象所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 漂白粉溶液 | 酸性:HCl>H2CO3>HClO |
| B | 盐酸 | 硫化亚铁 | 硫酸铜溶液 | 酸性:HCl>H2S>H2SO4 |
| C | 水 | 过氧化钠 | 水 | 过氧化钠与水的反应是放热反应 |
| D | 浓盐酸 | 二氧化锰 | 碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com