
| A£® | »ģŗĻĪļĄļ3ÖÖĪļÖŹ·“Ó¦Ź±ĻūŗÄŃĪĖįµÄĪļÖŹµÄĮæÅضČÖ®±ČĪŖ1£ŗ1£ŗ3 | |
| B£® | ·“Ó¦ŗóĖłµĆČÜŅŗÖŠµÄFe2+Ąė×ÓÓėCl-Ąė×ÓµÄĪļÖŹµÄĮæÅضČÖ®±ČĪŖ1£ŗ1 | |
| C£® | »ģŗĻĪļĄļ£¬FeOµÄĪļÖŹµÄĮæĪŽ·ØČ·¶Ø£¬µ«Fe±ČFe2O3µÄĪļÖŹµÄĮæ¶ą | |
| D£® | »ģŗĻĪļĄļ£¬Fe2O3µÄĪļÖŹµÄĮæĪŽ·ØČ·¶Ø£¬µ«Fe±ČFeOµÄĪļÖŹµÄĮæ¶ą |
·ÖĪö »ģŗĻĪļĒ”ŗĆĶźČ«Čܽā£¬ĒŅĪŽFe3+£¬¹ŹČÜŅŗÖŠČÜÖŹĪŖFeCl2£¬n£ØHCl£©=0.2mol£¬n£ØH2£©=$\frac{0.448L}{22.4L/mol}$=0.02mol£¬n£ØFe2+£©=0.1mol£¬ÓÉ·“Ó¦2Fe3++FeØT3Fe2+ÖŖFe±ČFe2O3µÄĪļÖŹµÄĮæ¶ą£¬µ«FeOµÄĪļÖŹµÄĮæĪŽ·ØČ·¶Ø£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗA£®øł¾ŻŅŌÉĻ·ÖĪöÖŖFe±ČFe2O3µÄĪļÖŹµÄĮæ¶ą£¬µ«FeOµÄĪļÖŹµÄĮæĪŽ·ØČ·¶Ø£¬¹ŹĪŽ·ØČ·¶Ø»ģŗĻĪļĄļČżÖÖĪļÖŹ·“Ó¦Ź±ĻūŗÄŃĪĖįµÄĪļÖŹµÄĮæÖ®±Č£¬¹ŹA“ķĪó£»
B£®·“Ó¦ŗóĖłµĆČÜŅŗĪŖFeCl2ČÜŅŗ£¬ŃōĄė×ÓÓėŅõĄė×ÓµÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ2£¬¹ŹB“ķĪó£»
C£®»ģŗĻĪļĒ”ŗĆĶźČ«Čܽā£¬ĒŅĪŽFe3+£¬¹ŹČÜŅŗÖŠČÜÖŹĪŖFeCl2£¬ÓÉĢśÓėĖį·“Ӧɜ³ÉĒāĘų¼°·“Ó¦2Fe3++FeØT3Fe2+ÖŖFe±ČFe2O3µÄĪļÖŹµÄĮæ¶ą£¬µ«FeOµÄĪļÖŹµÄĮæĪŽ·ØČ·¶Ø£¬¹ŹCÕżČ·£»
D£®FeOµÄĪļÖŹµÄĮæĪŽ·ØČ·¶Ø£¬²»ÄÜČ·¶ØFeÓėFeOµÄĪļÖŹµÄĮæµÄ¹ŲĻµ£¬¹ŹD“ķĪó£®
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²é»ģŗĻĪļµÄ¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕ·¢ÉśµÄ·“Ó¦”¢ĪļÖŹµÄĮæ¹ŲĻµĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓė¼ĘĖćÄÜĮ¦µÄ漲飬עŅāČÜŅŗÖŠĪŽFe3+Ąė×Ó£¬ĢāÄæÄѶČÖŠµČ£®


 ĆūÅĘѧŠ£·Ö²ćÖÜÖܲāĻµĮŠ“š°ø
ĆūÅĘѧŠ£·Ö²ćÖÜÖܲāĻµĮŠ“š°ø »ĘøŌŗ£µķČ«³ĢÅąÓŲāŹŌ¾ķĻµĮŠ“š°ø
»ĘøŌŗ£µķČ«³ĢÅąÓŲāŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·ÖÉ¢ĻµÖŠ·ÖÉ¢ÖŹĮ£×ÓÖ±¾¶ÓÉŠ”µ½“óµÄÕżČ·Ė³ŠņŹĒ£ŗČÜŅŗ£¼½ŗĢ壼×ĒŅŗ | |
| B£® | ½«ÄÉĆײÄĮĻ£ØĪ¢Į£Ö±¾¶ŹĒ1nm-100nm£©·ÖÉ¢µ½·ÖÉ¢¼ĮÖŠµĆµ½µÄ·ÖÉ¢ĻµÓŠ¶”“ļ¶ūŠ§Ó¦ | |
| C£® | ĒāŃõ»ÆĢś½ŗĢåµÄÖʱø·½·ØŹĒ£ŗ½«ĒāŃõ»ÆĢś¹ĢĢåČÜÓŚ·ŠĖ®ÖŠ¼ĢŠųÖó·Š | |
| D£® | ½ŗĢåÓėĘäĖü·ÖÉ¢ĻµµÄ±¾ÖŹĒų±šŹĒ½ŗĢåµÄ·ÖÉ¢ÖŹĮ£×ÓµÄĪ¢Į£Ö±¾¶ŌŚ1nm-100nmÖ®¼ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Čō¢ń“ļµ½Ę½ŗāŹ±£¬A”¢B”¢Cø÷Ōö¼Ó1mol£¬ŌņBµÄ×Ŗ»ÆĀŹŅ»¶ØŌö“ó | |
| B£® | ČōĻņĘ½ŗā¢ńÖŠŌŁ¼ÓČė6mol A£¬4mol B£®²āµĆCµÄĢå»ż·ÖŹż“óÓŚa£¬æɶĻ¶Øx£¾4 | |
| C£® | Čōx=2£¬ŌņĢåĻµ¢ņĘšŹ¼ĪļÖŹµÄĮæÓ¦Āś×ć£ŗ3n£ØB£©=n£ØA£©+3 | |
| D£® | ČōĢåĻµ¢ņĘšŹ¼ĪļÖŹµÄĮæĀś×ć3n£Øc£©+4n£ØA£©=12n£ØB£©£¬ŌņæÉĶʶĻ£ŗx=4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
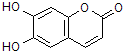
| A£® | MµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒ180 | |
| B£® | 1 mol M×ī¶ąÄÜÓė2 mol Br2·¢Éś·“Ó¦ | |
| C£® | MÓė×ćĮæµÄNaOHČÜŅŗ·¢Éś·“Ó¦Ź±£¬ĖłµĆÓŠ»ś²śĪļµÄ»ÆѧŹ½ĪŖC9H4O5Na4 | |
| D£® | 1 mol MÓė×ćĮæH2·“Ó¦£¬×ī¶ąĻūŗÄ5 mol H2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
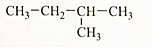
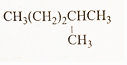 £Ø4£©
£Ø4£©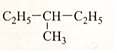 £Ø5£©£ØCH3£©2CH-CH2-CH2-CH3£®
£Ø5£©£ØCH3£©2CH-CH2-CH2-CH3£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | c£ØNa+£©=2c£ØS2-£© | B£® | c£ØOH-£©=c£ØH+£©+c£ØHS-£©+2c£ØH2S£© | ||
| C£® | c£ØNa+£©£¾c£ØS2-£©£¾c£ØHS-£©£¾c£ØOH-£© | D£® | c£ØNa+£©+c£ØH+£©=c£ØOH-£©+c£ØHS-£©+c£ØS2-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
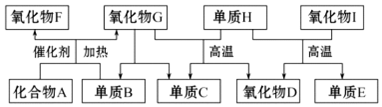
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ”” ČÜÖŹ Čܽā¶Č ČܼĮ | ””AgNO3 | ””Ba£ØNO3£©2 | ””AgCl | BaCl2 |
| ”””” Ė®ÖŠ | 170 | 9.2 | 1.5”Į10-4 | 33.3 |
| ””””””Ņŗ°± | 86 | 97.2 | 0.8 | 0 |
| A£® | ¢Ł¢Ū | B£® | ¢Ł¢Ü | C£® | ¢Ś¢Ū | D£® | ¢Ś¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “ĪĀČĖįµÄµē×ÓŹ½£ŗ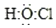 | |
| B£® | ÖŠ×ÓŹżĪŖ 20 µÄĀČŌ×Ó£ŗ${\;}_{17}^{37}$Cl | |
| C£® | µŖŌ×ӵĽį¹¹Ź¾ŅāĶ¼£ŗ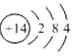 | |
| D£® | Na2 S µÄĖ®½ā·“Ó¦·½³ĢŹ½£ŗS2-+2H2O?H2S+2OH- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com