
| 方案 | 选用药品 | NaNO2溶液中的实验现象 | 利用NaNO2性质 |
| 方案1 | FeCl2和KSCN溶液 | ① | 氧化性 |
| 方案2 | ② | 溶液变蓝 | 氧化性 |
| 方案3 | FeCl3溶液 | ③ | 碱性 |
| 方案4 | 酸性KmnO4溶液 | 紫色溶液腿色 | ④ |
| 10-14 |
| 10-10 |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| 元素符号 | 电负性 | 元素符号 | 电负性 |
| Li | 0.98 | Be | 1.57 |
| B | 2.04 | C | 2.55 |
| O | 3.44 | F | 3.98 |
| Na | 0.93 | Al | 1.61 |
| Si | 1.90 | P | 2.19 |
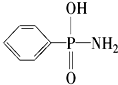 ,在P-N键中,你认为共用电子对偏向
,在P-N键中,你认为共用电子对偏向查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量石灰水滴入碳酸氢钠溶液中 HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
B、碳酸氢铵与足量氢氧化钠两种浓溶液混合加热 NH4++OH-
| ||||
| C、用惰性电极电解氯化钠溶液 2H2O+2Cl-═Cl2↑+H2↑+2OH- | ||||
| D、亚硝酸钠水溶液显碱性 NO2-+H2O?HNO2+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
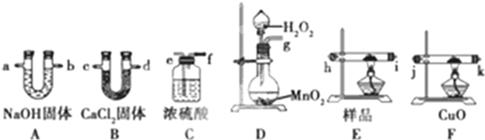
查看答案和解析>>
科目:高中化学 来源: 题型:
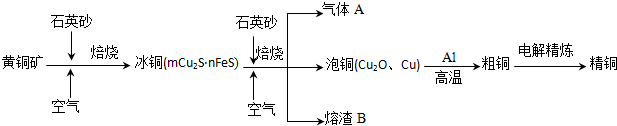
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白色沉淀是CuI2,棕色溶液含有I2 |
| B、滴加KI溶液时,转移2mol e-时生成1mol白色沉淀 |
| C、通入SO2时,SO2与I-反应,I-作还原剂 |
| D、上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若固体完全溶解,则粉末中不可能有Cu2O |
| B、若固体不能完全溶解,则粉末中肯定有Cu2O |
| C、若固体完全溶解,溶液中再加KSCN,变红,则原粉末仅是Fe2O3 |
| D、若固体不能完全溶解,溶液中再加KSCN,不变红,则原粉末仅是Cu2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com