
| A、35Cl和37Cl互为同素异形体 | ||||
| B、O2和O3是氧元素的两种同位素 | ||||
| C、35Cl和37Cl中35、37表示的是质量数 | ||||
D、1
|


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
| A、在氧化还原反应中,一定是一种元素被氧化,另一种元素被还原 |
| B、在氧化还原反应中,不一定所有元素的化合价都发生改变 |
| C、氧化还原反应的实质是元素化合价的升降 |
| D、某元素由化合态转化为游离态,这种元素一定被还原了 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用醋酸检验牙膏中的摩擦级碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
| C、酸性KI淀粉溶液久置后变蓝:4l-+O2+4H+=2I2+2H2O |
| D、Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol.L-1 |
| B、0.2mol.L-1 |
| C、0.4mol.L-1 |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与28 g CO具有相同分子数的CO2的质量一定是44 g |
| B、在标准状况下,11.2 L某气体的质量为22 g,则该气体的相对分子质量是44 g/mol |
| C、16 g O2和16 g O3含的氧原子个数一样多 |
| D、1 L 1 mol?L-1Fe(OH)3胶体中胶体微粒数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
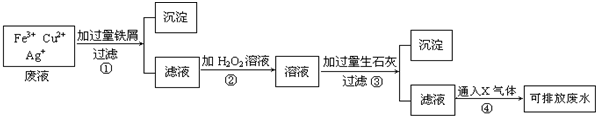
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com