
����Ŀ��Q��R��X��Y��Z��L����Ԫ�ص�ԭ��������������R��L��ͬ����Ԫ�أ�R�������������ȴ�����������1��L�ĵ��ʳ��³�ѹ�����Ϻ�ɫ���塣Q��X�γɵ����ӻ�����XQ�Ǽ�ʯ�ҵ���Ҫ�ɷ֡�X��Y��Zλ��ͬһ���ڣ�Y����Χ��������������������6����Zλ��ds���Ҳ��ܺ�ϡ���ᷴӦ����H2����ش��������⣺
��1��Q�ļ۲�����Ų�ʽΪ___________________��L�ĺ�����HLO3��L���ӻ���ʽΪ__________�����LO3-�����ӹ���Ϊ________________��
��2��ZR42-��������______����ZSO4��Һ�м������KCN�����������[Z��CN��4]2������1mol��������к��еĦм�����Ŀ��_______����Zͬ���ڵ�Ԫ���У���Zԭ��������������ȵ�Ԫ�ػ���_________����Ԫ�ط��ţ�
��3��Y�������������ͼ��ʾ��������״�ṹ�����������Ļ�ѧʽΪ______________��

��4��X��Z�ľ���ѻ�ģ����ͬ����λ��Ϊ______________����֪Xԭ�Ӱ뾶ԼΪ200pm������X���ܶ�Ϊ__________________g/cm3(������������λ��Ч����)��
��5��XL2���庬�в�״�ṹ���������ǿ���Թ��ۼ�������Է��»��������ӣ���XL2�ľ���������___________��
���𰸡�2s 22p4 sp3 ������ Cl- 4.82��1024 K��Cr CrO3 12 1.5 ����;��������;���
��������
L�ĵ��ʳ��³�ѹ�����Ϻ�ɫ���壬��LΪ�⣻Q��X�γɵ����ӻ�����XQ�Ǽ�ʯ�ҵ���Ҫ�ɷ���Q��R��X��Y��Z��L����Ԫ�ص�ԭ������������������XΪ�ơ�QΪ ����R��L��ͬ����Ԫ�أ�R�������������ȴ�����������1������RΪ�ȣ�X��Y��Zλ��ͬһ���ڣ�Y����Χ��������������������6����Zλ��ds���Ҳ��ܺ�ϡ���ᷴӦ����H2��Y����������Ϊ24,��YΪCrԪ��, ZΪCuԪ����
��1������������֪QΪ��Ԫ�أ��ȵļ۲�����Ų�ʽΪ2s 22p4��L�ĺ�����HIO3�к�����HLO3��HIO3,��ṹΪ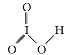 ,����ɵ��ӻ������Ϊ7+4-3
,����ɵ��ӻ������Ϊ7+4-3![]() 2=4,Ϊsp3�ӻ�,���ڳɼ����Ӷ�Ϊ3��,�Һ���һ�Թ¶Ե���,��֪IO3-�Ľṹ����Ϊ������,�𰸣�2s22p4 sp3 ��������
2=4,Ϊsp3�ӻ�,���ڳɼ����Ӷ�Ϊ3��,�Һ���һ�Թ¶Ե���,��֪IO3-�Ľṹ����Ϊ������,�𰸣�2s22p4 sp3 ��������
��2��ZR42-��������Cl-��1��CN�ṹ�к��������м�����1mol[Z��CN��4]2-�к���8mol�м�,����1mol��������к��еĵ���Ŀ��6.02![]() 1023
1023![]() 8=4.82��1024���𰸣�4.82��1024��
8=4.82��1024���𰸣�4.82��1024��
(3)YΪCr,����Cr�Ļ��ϼ��ص��Լ��۲�ṹ��֪����������ԭ��ΪCrԭ��,��Crԭ�Ӽ���һ��Oԭ�ӽ�������,����������Oԭ����������Crԭ��,��һ��Crռ��һ��Oԭ��,��ÿ��Crԭ���ϻ�������û�гɼ���Oԭ��,����ÿ��Crռ��3��Oԭ��,���仯ѧʽΪCrO3;�𰸣�CrO3��
(4)����������֪XΪ�ƣ�ZΪͭ�����ߵľ���ѻ�ģ����ͬ,��Ca��Cu�Ķѻ�ģ����ͬ,��Cu�Ķѻ�ģ��Ϊ�����������ܶѻ���: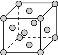 ,��λ��Ϊ12�����ݽṹ��֪һ�������к���4��Caԭ��,����ԭ�Ӱ뾶Ϊ200pm=2��10-8cm,һ������������Caԭ�ӵ�����Ϊ(4��40)/NA,���ΪV=(
,��λ��Ϊ12�����ݽṹ��֪һ�������к���4��Caԭ��,����ԭ�Ӱ뾶Ϊ200pm=2��10-8cm,һ������������Caԭ�ӵ�����Ϊ(4��40)/NA,���ΪV=(![]() r)3,���Լ���ɵ�Ca���ܶ�Ϊ4��40g/6.02��1023(2
r)3,���Լ���ɵ�Ca���ܶ�Ϊ4��40g/6.02��1023(2![]() ��2��10-8cm)3=1.468g/cm2��1.5g/cm3���𰸣�12��1.5��
��2��10-8cm)3=1.468g/cm2��1.5g/cm3���𰸣�12��1.5��
(5)XL2ΪCaCl2,���ھ����к��в�״�ṹ,�Ҳ�����ǿ���Թ��ۼ�,��京�з��»���,���Կ���֪���侧������Ϊ����;��������;��塣�𰸣�����;��������;��塣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FePO4��һ��������ˮ�İ�ɫ���壬���ý�����������Ҳ�������Ʊ��綯������ص���������LiFePO4��ʵ��������FeSO47H2O��H3PO4���������Ʊ�FePO4 ��LiFePO4��������ͼ��
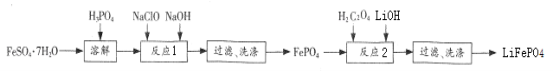
�ش��������⣺
(1)���ܽ���ʱH3PO4���˹���̫���ԭ����__________��
(2)��ϴ��FePO4�����IJ�����__________��
���������ϴ�Ӻ�������FePO4���Գ���ɫ������FePO4������ܻ��е�������_____��
(3)����Ӧ1��ʱ�ܷ�Ӧ�����ӷ���ʽ��_____________��
(4)����Ӧ2��ʱ�ܷ�Ӧ�Ļ�ѧ����ʽ����2LiOH + 6H2C2O4 + 2FePO4![]() 2LiFePO4 + 7CO2 + 5X +7H2O ������X�Ļ�ѧʽΪ____��ÿ����1molLiFePO4���÷�Ӧת��_______mole-��
2LiFePO4 + 7CO2 + 5X +7H2O ������X�Ļ�ѧʽΪ____��ÿ����1molLiFePO4���÷�Ӧת��_______mole-��
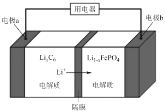
(5)LiFePO4����ȶ��Ըߡ���ȫ���Ի����Ѻã��õ�ص��ܷ�Ӧʽ�ǣ�LiFePO4 + C6 ![]() Li1��xFePO4 + LixC6����ŵ�ʱ����ԭ����ͼ��ʾ��
Li1��xFePO4 + LixC6����ŵ�ʱ����ԭ����ͼ��ʾ��
���ʱ��a���ĵ缫��ӦʽΪ_____________��
�ŵ�ʱ��b���ĵ缫��ӦʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����Ʊ�����ˮ�ij��÷�������ͼ��ʾ����װ�ö�������ȡ����ˮ��
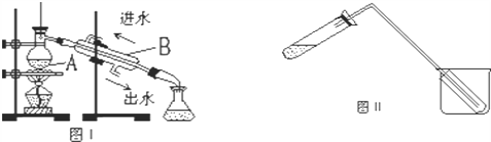
��1��ͼ����ʵ������ȡ����ˮ�ij���װ�ã�����A��B�����Ʒֱ�����
A_________��B___________
��2���¶ȼ�ˮ����Ӧ����_________________________
��3��ʵ��ʱA �г�����һ����������ˮ�⣬�����������________����������___________��
��4��ͼ��װ��Ҳ��������������ˮ����ȡ�����ȼ��̶������ԣ�����ԭ����ͼI��ȫ��ͬ����װ����ʹ�õIJ������ܽϳ�����������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£�2LNH3��2L NO���в�ͬ��
A.��ԭ����B.����C.������D.��������ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��µ�ˮ��Һ������Ũ��������ͼ��ʾ������˵������ȷ����
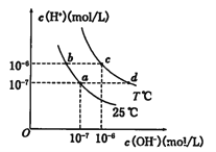
A. ��b���Ӧ�Ĵ�����Һ�еμ�NaOH��Һ��a������ʱc(Na+)=c(CH3COO-)
B. 25��ʱ������CH3COONa����������c��d�ı仯�����¿�������a��c�ı仯
C. T��ʱ����pH=2��������pH=10��KOH�������Ϻ���Һ������
D. b���Ӧ����Һ�д������ڣ�K����Ba2����NO3-��I��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����������װ��̽�������백��֮��ķ�Ӧ������A��F�ֱ�Ϊ�����������ķ���װ�ã�CΪ��������������백��������Ӧ��װ�á�
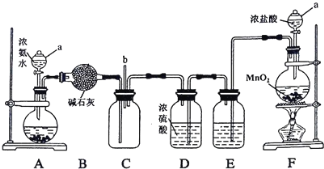
��ش��������⣺
��1������a������Ϊ_________��װ��A��Բ����ƿ��ʢ�ŵĹ������ʿ�ѡ��__________(�����)��
a���Ȼ��� b���������� c��̼���
��2��װ��F��Բ����ƿ�з�����Ӧ�����ӷ���ʽΪ___________��װ��E��ϴ��ƿ��ʢ�ŵ��Լ�Ϊ ____________��
��3����Ӧ�����У�װ��C�ļ���ƿ���д������̲�������һ�ֲ���Ϊ��������Ҫ�ɷ�֮һ���÷�Ӧ�Ļ�ѧ����ʽΪ _________��
��4����װ��C��b���ݳ���β���к�������Cl2��Ϊ��ֹ����Ⱦ�������ɽ�β��ͨ��ʢ�� ________��Һ��ϴ��ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���л�ѧ��Ӧ�����ӷ���ʽ����
A. ����������Һ������ķ�Ӧ��OH-��H+===H2O
B. �����ʯ��ˮ��ϡ���ᷴӦ��Ca(OH)2��2H+===Ca2+��2H2O
C. ͭƬ������������Һ�У�Cu��Ag+===Cu2+��Ag
D. ̼�������ϡ�����У�CaCO3��2H+="==" Ca2+��H2O��CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��A��B��C��D ԭ��������������������������֮��Ϊ17��B��D ͬ���壬��������Cԭ�Ӱ뾶���B�����������Ǵ�����3���������ƶϲ���ȷ����
A. Ԫ��B��C��D �γɵĻ������ˮ��Һ������
B. Ԫ��B��C �γɵĻ������п��ܼȺ������Ӽ��ֺ����ۼ�
C. ���Ӱ뾶�Ӵ�С��˳��ΪD>B>C
D. Ԫ��B �ļ���̬�⻯������ȶ��Ա�D ��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA Ϊ�����ӵ�������ֵ������˵����ȷ����
A. 1 L 1 mol��L��1��NaHCO3 ��Һ�к���HCO3������ĿΪNA
B. 78 g ������C=C ˫������ĿΪ3NA
C. ���³�ѹ�£�6. 72 L NO2��ˮ��ַ�Ӧת�Ƶĵ�����ĿΪ0. 1NA
D. ������������ǵĻ����30g����̼ԭ����ΪNA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com