
分析 燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物.
解答 解:1g CH4完全燃烧生成液态水和CO2气体,放出55.6kJ的热量,则1mol即16g CH4完全燃烧生成液态水和CO2气体,16×55.6kJ=889.6kJ,则甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1,依据热化学方程式和燃烧热概念可知,CH4的燃烧热为889.6KJ/mol,答:CH4的燃烧热为889.6KJ/mol.
点评 本题主要考查了燃烧热的计算,反应热的数值与化学方程式前面的系数成正比,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
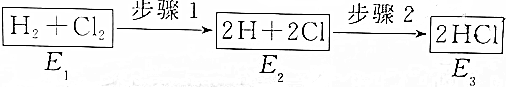
| A. | 步骤2是放热反应 | B. | 三个状态的能量E2最大 | ||
| C. | 要实现步骤1的转化,必须加热 | D. | 该反应放出的热量为E1一E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 13 | C. | 16 | D. | 19 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
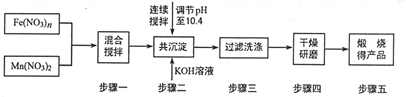 随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:(提示:锰元素在本题所有过程中价态均不变).
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:(提示:锰元素在本题所有过程中价态均不变).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 第二周期中形成化合物最最多的元素 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期中可以作为半导体材料的元素 |
| E | 第四周期中最外层只有一个电子且内层完全排满电子的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com