
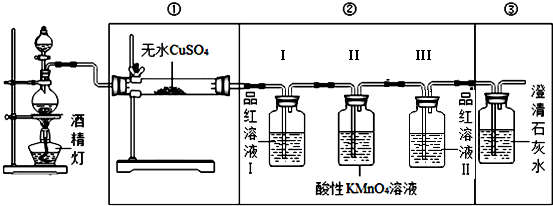
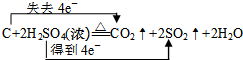 .
.
| 实验装置 | ① | ③ |
| 实验现象 |
分析 C与浓硫酸反应生成二氧化碳、二氧化硫和水,要探究浓硫酸与木炭反应后产生气体的成分,应首先验证水,利用无水硫酸铜验证即可,若无水硫酸铜变蓝,则证明有水生成,要验证二氧化碳,必须排除二氧化硫的干扰,故接着应利用二氧化硫可以使品红溶液褪色的特征验证二氧化硫,验证二氧化碳需要除净二氧化硫,可以采用高锰酸钾吸收,过后再次利用品红溶液验证二氧化硫是否除净,据此解答各小题即可.
解答 解:(1)C与浓硫酸反应生成二氧化碳、二氧化硫和水,此过程中C元素化合价由0价升高到+4价、S元素化合价由+6价降低到+4价,故电子转移与方向为: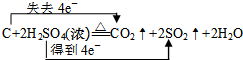 ;
;
故答案为: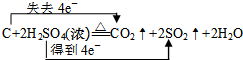 ;
;
(2)装入试剂前,应首先检验装置的气密性;
故答案为:检验装置气密性;
(3)由于C与浓硫酸反应生成水,故①中无水CuSO4变为蓝色; ③若石灰水变浑浊,说明含有二氧化碳;
故答案为:①无水CuSO4变为蓝色; ③石灰水变浑浊;
(4)依据分析可知,②中品红溶液Ⅰ的作用验证是否生成二氧化硫,Ⅲ的作用验证二氧化硫是否被除尽,
故答案为:验证烧瓶中有SO2;确认SO2除尽.
点评 本题考查了探究C与浓硫酸的反应、氧化还原反应,题目难度不大,注意从化合价的角度分析氧化还原反应,明确反应原理、以及二氧化硫和二氧化碳的检验方法是解题的关键.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
1L某溶液中存在下列离子:Ba2+、Fe2+、Al3+、Fe3+、Mg2+ 、HCO3-、CO32-、Cl-、NO3-、SO42- 中的五种,浓度均为0.1mol/L,若向原溶液中加入足量的盐酸,有气体生成。经分析知:反应后的溶液中的阴离子的种类没有变化。则下列说法正确的是
A.原溶液中一定含有HCO3-或CO32-
B.原溶液中可能含有Ba2+、Al3+
C.若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液不显血红色
D.若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
中国历史悠久,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确的是( )
A.闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺
B.四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.由于中国大部分地区都缺碘,而缺碘就会引起碘缺乏病,80年代国家强制给食用的氯化钠食盐中加入碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
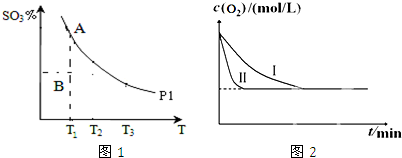
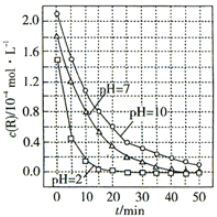
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
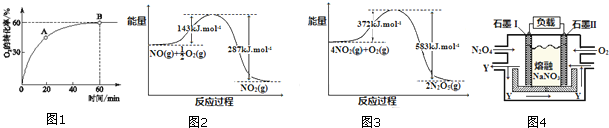
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
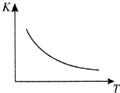 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
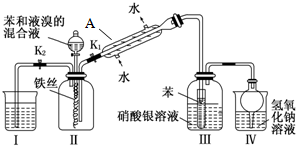
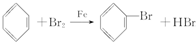
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
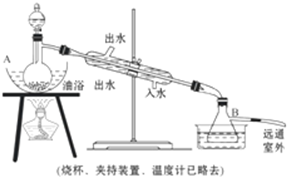
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com