
| A. | $\frac{{K}_{w}}{c(O{H}^{-})}$=0.1mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| D. | 加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
分析 A.该溶液中存在大量氢离子,硅酸根离子与氢离子反应;
B.遇苯酚显紫色的溶液中存在铁离子,铁离子与硫氰根离子、碘离子反应;
C.与铝反应产生大量氢气的溶液中存在大量氢离子或氢氧根离子,碳酸根离子与氢离子反应,铵根离子与氢氧根离子反应;
D.碳酸根离子、钙离子与氢氧根离子反应生成碳酸钙沉淀,铵根离子与氢氧根离子反应生成氨气.
解答 解:A.该溶液为酸性溶液,溶液中存在大量氢离子,SiO32-与氢离子反应,在溶液中不能大量共存,故A错误;
B.遇苯酚显紫色的溶液中存在铁离子,铁离子与I-、SCN-反应,在溶液中不能大量共存,故B错误;
C.与铝反应产生大量氢气的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,NH4+与氢氧根离子反应,CO32-与氢离子反应,在溶液中不能大量共存,故C错误;
D.Ca2+、HCO3-与NaOH溶液反应生成碳酸钙沉淀,NH4+与NaOH加热反应生成氨气,满足条件,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.


科目:高中化学 来源: 题型:解答题
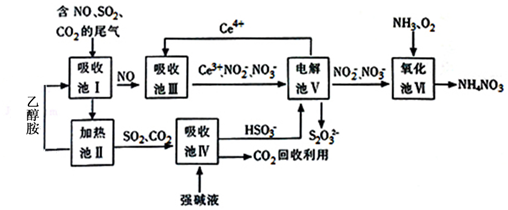
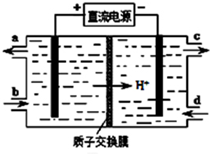
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| B. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| C. | 金属离子在反应中可能被氧化、也可能被还原 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 28g N2和N4组成的混合气体中含有的原子数为2 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中存在非极性键 | |
| B. | Na2O2属于电解质,而Cl2、SO2均属于非电解质 | |
| C. | Na2O2与SO2反应和Na2O2与CO2反应完全相同 | |
| D. | 将等物质的量Cl2和SO2同时通入品红溶液,溶液褪色更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中;c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3mol•L-1 | |
| B. | 常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| C. | NH4HSO3溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中消耗的Zn的质量为97.5 g | B. | 气体A中SO2和H2的体积比为1:4 | ||
| C. | 反应中被还原的元素只有一种 | D. | 反应中共转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水中含有丰富的碘元素,故碘被称为“海洋元素” | |
| B. | 溴化银是一种重要的感光材料,也可用于人工降雨 | |
| C. | 钠在盛有氯气的集气瓶中燃烧,火焰呈苍白色,产物为NaCl;铁在盛有氯气的集气瓶中燃烧,火焰呈棕黄色,产物为FeCl3 | |
| D. | 工业炼铁的设备是炼铁高炉,过程中加入石灰石的作用是除脉石(SiO2)造渣 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA | |
| B. | 3.4g NH3中含原子总数目为0.6NA | |
| C. | 新制的含NA个Fe(OH)3分子的氢氧化铁胶体中,含有胶粒的物质的量为1mol | |
| D. | 23gNO2和N2O4的混合气体中含有原子总数1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com