
| A. | 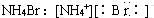 | B. |  | ||
| C. | 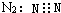 | D. | 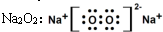 |
分析 A、NH4Br为离子化合物,由铵根离子和溴离子构成;
B、氯化钙为离子化合物,由2个氯离子和1个钙离子构成;
C、氮气为单质,氮原子间存在三对共用电子对;
D、过氧化钠为离子化合物,由2个钠离子和1个过氧根构成.
解答 解:A、溴化铵是离子化合物,由氨根离子与溴离子构成,电子式为: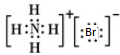 ,故A错误;
,故A错误;
B、CaCl2是离子化合物,由钙离子与氯离子构成,电子式为 ,故B错误;
,故B错误;
C、氮气为单质,氮原子间存在三对共用电子对,N2的电子式为: ,故C错误;
,故C错误;
D、Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
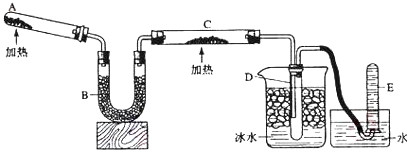
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
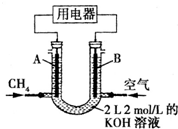 将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷在点燃前需进行验纯 | |
| B. | 甲烷能使酸性高锰酸钾溶液褪色 | |
| C. | 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构 | |
| D. | 甲烷不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯中混有的少量硫酸和硝酸,将其倒入盛有NaOH溶液的分液漏斗中,振荡,静置,分液 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出碘 | |
| D. | 乙烯中混有SO2和CO2,将其通入溴水中洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加CO的量 | B. | 增大压强 | C. | 升高温度 | D. | 加入稀有气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有 x+1 | B. | 可能是 x+8或 x+18 | ||
| C. | 可能是 x+2 | D. | 可能是 x+1或 x+11或x+25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com