
【化学-物质结构与性质】
配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)写出元素D在周期表中的位置是 ,B原子的外围电子排布图 。E原子的核外有 种不同运动状态的电子,B和C的第一电离能大小关系 。(用元素符号表示)
(2)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,画出原子个数比为1:1的化合物的电子式 ,两种化合物可任意比互溶,解释其主要原因为 。
(3)该配位化合物的化学式为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
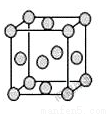
(5)已知E的晶胞结构如图所示,此晶胞立方体的边长为a cm,E单质的密度为pg.cm-3,则阿伏伽德罗常数为 (用a、p表示)。该晶胞配位数为 ,EDC4常作电镀液,其中DC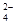 的空间构型是 ,其中D原子的杂化轨道类型是 。若电解EDC4的水溶液,则电解总反应的化学方程式为 。
的空间构型是 ,其中D原子的杂化轨道类型是 。若电解EDC4的水溶液,则电解总反应的化学方程式为 。
科目:高中化学 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
G20杭州峰会主题为“构建创新、活力、联动、包容的世界经济”,杭州为此次峰会大量引进了“钒电池”新能源公交车,“钒电池”的原理是利用钒的不同价态之间的转化,其充电原理可表示为2H+ + V2++ VO2+ = 2V3++ H2O,则下列说法不正确的是
A.阴极反应可表示为2H++VO2++e-=V3++H2O
B.阳极反应可表示为V2+-e-=V3+
C.放电过程种负极反应可表示为V3++2OH--e-=VO2++H2O
D.电解液体积为1L,pH=1,C(H+)=0.1mol/L;Ph=2;C(H+)=0.01mol/L;消耗氢离子的量为0.09mol;根据:2H++VO2++e-=V3++H2O关系:生成V3+的物质的量浓度为0.045mol/L
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:选择题
已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是NaOH溶液,E是CO2,则B为NaHCO3
D.若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上11月月考化学卷(解析版) 题型:填空题
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
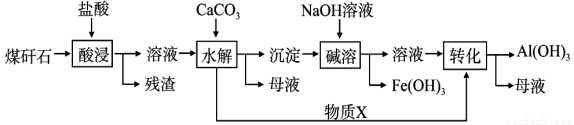
(1)“酸浸”过程中主要反应的离子方程式为:___________、___________。
(2)“酸浸”时,提高浸出速率的具体措施有___________、___________。(写出两个)
(3)“碱溶”的目的是___________。物 质X的化学式为___________。
质X的化学式为___________。
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:___________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上11月月考化学卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
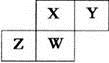
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上模拟四化学卷(解析版) 题型:选择题
X、Y、M、N是短周期且原子序数依次增大的主族元素。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大。下列有关说法正确的是( )
A. M、N的简单离子半径:r(N-)>r(M2﹣)
B. 气态氢化物的稳定性:M>X
C. X、Y形成的化合物中只有离子键
D. X、Y、N所形成化合物的水溶液可能显中性或碱性
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:实验题
高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:
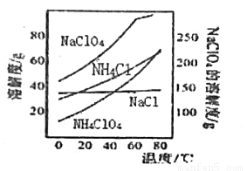
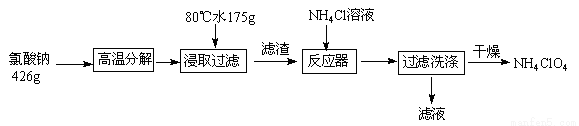
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为_______________。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为_________________(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为 _____________________。
(4)已知:2NH4ClO4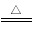 N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集。

①E中收集到的气体可能是__________________(填化学式)
②A、B、C中盛放的药品依次可以是__________(选填:“I”“II”“III”)。
I.abd II.cbe III.bcf
(5)过滤用到的主要玻璃仪器是____________________。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
从下列实验事实所列出的相应结论不正确的是
实 验事实 | 结 论 | |
① | SO2使酸性高猛酸钾溶液褪色 | 可证明SO2有漂白性 |
② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用硫磺粉处理洒落的金属汞 | 都发生了氧化还原反应 |
③ | 取少Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,再滴加稀盐酸,沉淀不溶解 | 证明Na2SO3己氧化变质 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的气体,另取该溶液滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
⑤ | 在某溶液中加入适量新制饱和氯水,再加入CCl4震荡,CCl4层呈橙红色 | 该溶液一定有Br-存在 |
A.①③④ B.②③⑤ C.④⑤ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
把0.6molX气体和0.4molY气体混合于2L容器中使它们发生如下反应反应: 3X(g)+Y(g)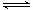 nZ(g)+2W(g);5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应速率为0.01 mol/( L·min),则上述反应中Z气体的反应方程式中化学计量系数n的值是
nZ(g)+2W(g);5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应速率为0.01 mol/( L·min),则上述反应中Z气体的反应方程式中化学计量系数n的值是
A.1 B.2 C.3 D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com