


| 1000a |
| 46 |
| V |
| 22.4 |
| 1000a |
| 46 |
| V |
| 22.4 |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
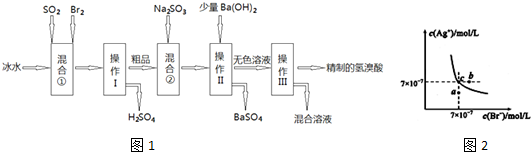
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、34S原子核内中子数为16 |
| B、1H216O和1H218O的相对分子质量相差2 |
| C、13C和15N原子的原子序数相差2 |
| D、2H+结合OH-的能力比1H+的更强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生利用如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
某学生利用如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (I)如图是某学校林老师制备NH3并进行性质实验时的改进装置.按图1把仪器安装好,称取2g固体氯化铵装入试管底部,再称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.
(I)如图是某学校林老师制备NH3并进行性质实验时的改进装置.按图1把仪器安装好,称取2g固体氯化铵装入试管底部,再称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.查看答案和解析>>
科目:高中化学 来源: 题型:
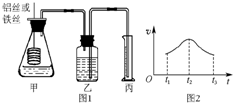 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.
某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn、Ag |
| B、Cu、Fe |
| C、Al、Fe |
| D、Mg、Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com