
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
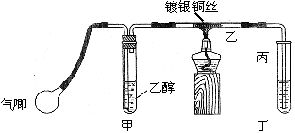
 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.| 铜 |
| △ |
| 铜 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| Cu |
| △ |
| Cu |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
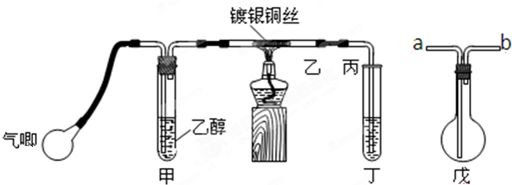
 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com