
【题目】碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示. 
请回答下列问题:
(1)碘是物质,实验室常用方法来分离提纯含有少量杂质的固体碘.
(2)写出碘酸钾在酸性介质中与过氧化氢反应的离子方程式:
(3)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.图中的序号3应为离子交换膜(填“阳”或“阴”);电解时,阳极上发生反应的电极反应式为 .
(4)教材中利用KI与空气的反应来探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、、;反应的离子方程式为 .
(5)已知KI+I2KI3 , 将I2溶于KI溶液,在低温条件下,可制得KI3H2O.该物质作为食盐加碘剂是否合适?(填“是”或“否”),并说明理由 . 为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 . A.Na2S2O3B.AlCl3C.Na2CO3D.NaNO2 .
【答案】
(1)紫黑色;升华
(2)2IO3﹣+2H++5H2O2=I2↓+5O2↑+6H2O
(3)阴;I﹣+6OH﹣﹣6e﹣=IO3﹣+3H2O
(4)淀粉溶液;0.1mol/LH2SO4溶液;4H++4I﹣+O2=2I2+2H2O
(5)否;低温制备的KI3受热易分解为I2 , 而I2受热易升华;AC
【解析】解:(1)碘是紫黑色固体;加热条件下碘易升华,杂质不易升华,所以采用升华的方法分离碘单质,所以答案是:紫黑色;升华;(2)KIO3在酸性介质中与过氧化氢作用生成单质碘和氧气,+5价碘元素降低生成碘单质,﹣1价的氧升高生成氧气,该反应的离子反应方程式为2IO3﹣+2H++5H2O2=I2↓+5O2↑+6H2O,所以答案是:2IO3﹣+2H++5H2O2=I2↓+5O2↑+6H2O;(3)电解时,阳极上发生氧化反应,碘离子向阳极移动,在阳极上失去电子生成碘酸根离子,电极反应式为I﹣+6OH﹣﹣6e﹣=IO3﹣+3H2O,所以阴极的阴离子氢氧根要移向阳极,所以图中的序号3应为阴离子交换膜,所以答案是:阴;I﹣+6OH﹣﹣6e﹣=IO3﹣+3H2O;(4)KI溶液在硫酸提供的酸性环境下,被氧气氧化成单质碘,碘单质遇到淀粉变蓝,通常利用此性质检验碘,从而判断反应速率的快慢,所以应先加入淀粉溶液,后加入0.1mol/LH2SO4溶液,反应的离子方程式为:4H++4I﹣+O2=2I2+2H2O,所以答案是:淀粉溶液;0.1mol/LH2SO4溶液;4H++4I﹣+O2=2I2+2H2O;(5)KI作为加碘剂的食盐在保存过程中,KI会被空气中氧气氧化,KI在潮湿空气中氧化的反应化学方程式为:4KI+O2+2H2O═2I2+4KOH,根据题目告知,KI3H2O是在低温条件下,由I2溶于KI溶液可制得.再由题给的信息:“KI+I2KI3”,可知KI3在常温下不稳定性,低温条件下易分解为KI和I2 , KI又易被空气中的氧气氧化,I2易升华,所以KI3H2O作为食盐加碘剂是不合适的;提高加碘盐(添加KI)的稳定性,主要是防止I﹣ 被氧化,根据题给信息“还原性:S2O32﹣>I﹣”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息“3I2+6OH﹣═IO3﹣+5I﹣+3H2O”,可知I2与OH﹣会发生反应生成IO3﹣和5I﹣ , 而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化.至于AlCl3 , 水解后呈酸性,且还原性I﹣>Cl﹣ , 所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,则NaNO2与KI能发生氧化还原反应为2NO2﹣+2I﹣+4H+=2NO↑+I2+2H2O,所以不能作稳定剂, 所以答案是:否;低温制备的KI3受热易分解为I2 , 而I2受热易升华;AC.


科目:高中化学 来源: 题型:
【题目】根据所学知识填空.
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) .
A.9
B.13
C.11~13之间
D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) .
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH﹣)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①和两种粒子的物质的量之和等于0.1mol.
②和两种粒子的物质的量之和比OH﹣多0.05mol.
(4)已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 , 上述离子浓度大小顺序关系中正确的是(选填序号) .
②若上述关系中C是正确的,则溶液中溶质的化学式是 .
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)c(NH3H2O)(填“>”、“<”、或“=).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于非氧化还原反应的是
A. 3CuS+8HNO3==3Cu(NO3)2+2NO↑+3S↓+4H2O
B. 3Cl2+6KOH==5KCl+KClO3+3H2O
C. 3H2O2+2KCrO2+2KOH==2K2CrO4+4H2O
D. 3CCl4+K2Cr2O7==2CrO2Cl2+2COCl2+2KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产生活中,我们会遇到各种各样的化学反应。请按要求回答下列问题:
(1)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、N2、Fe2O3、Fe、FeCl3 和 X。
①根据题意,可判断出X是_____________(写化学式)
②写出并配平该反应的化学方程式,并用双线桥标出电子转移的方向和数目:______。
(2)铝元素是自然界中含量最多的的金属元素,应用广泛。金属铝既能与酸反应又能与强碱反应,请写出铝与强碱反应的离子方程式__________________________________________ 。
(3)Na2O2可用作呼吸面具的供氧剂, 发生反应的化学方程式为__________________________。
(4)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式_________________________________。
(5)小苏打可作胃药,请写出其中和胃酸时的离子方程式______________________ 。
(6)在反应 3BrF3+5H2O = HBrO3+Br2+9HF+O2 中,被氧化的元素是____________,当有5 mol水反应时,由H2O还原的BrF3为______________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图所示化合物的说法不正确的是 ( ) 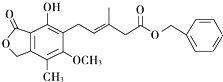
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1mol该化合物最多可以与3molNaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,相同质量的下列气体,占有体积由大到小的顺序是① Cl2② H2③ N2④ CO2⑤ O2
A.③②④⑤①B.⑤②④③①
C.①④⑤②③D.②③⑤④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在372K时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为 0.02molL﹣1 . 在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是( )
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01 molL﹣1s﹣1
B.在2s时体系内压强为开始时的1.1倍
C.在平衡时体系内含有N2O40.25 mol
D.平衡时,N2O4的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( ) 
A.该反应的△H<0,且p1<p2
B.反应速率:ν逆(状态A)>ν逆(状态B)
C.在C点时,CO转化率为75%
D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验步骤补全实验结论。
实验步骤 | 解释或实验结论 |
① 称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: |
② 将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | ②A的分子式为: . |
③ 另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况) | ③A中官能团的结构简式: 、 |
④ A的核磁共振氢谱如图: | ④A中含有 种氢原子 |
⑤ 综上所述,A的结构简式 . | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com