
分析 室温下,0.1mol•L-1的一元酸HA和c mol•L-1的一元碱BOH等体积混合,混合溶液的pH=7,则c(H+)=c(OH-)=10-7mol•L-1,
(1)由电荷守恒c(H+)+c(B+)=c(OH-)+c(A-)判断;
(2)溶液显中性,c(H+)=c(OH-);
(3)①终点时不慎多加了1滴HA溶液,即0.05mL,继续加水至50mL,根据c(H+)•c(OH-)=10-14计算c(H+),进而计算所得溶液的pH;
②t℃时pH=1的HA与pH=11的BOH等体积混合,混合溶液呈中性,即c(H+)=c(OH-);
③根据混合溶液呈酸性,计算混合溶液中c(H+).
解答 解:室温下,0.1mol•L-1的一元酸HA和c mol•L-1的一元碱BOH等体积混合,混合溶液的pH=7,则c(H+)=c(OH-)=10-7mol•L-1,
(1)由电荷守恒知c(H+)+c(B+)=c(OH-)+c(A-),由于c(H+)=c(OH-),故c(B+)=c(A-),故答案为:=;
(2)0.1mol•L-1的一元酸HA和c mol•L-1的一元碱BOH等体积混合,HA的pH=1,说明HA是强酸,BOH的pH=13,说明BOH是强碱,则c=0.1mol•L-1,故答案为:0.1;
(3)①终点时不慎多加了1滴HA溶液,即0.05mL,继续加水至50mL,
反应后溶液中c(H+)=$\frac{0.05}{50}$×0.1mol.L-1=10-4mol.L-1,pH=4,故答案为:4;
②pH=1的HA的c(H+)=10-1mol•L-1,pH=11的BOH的c(OH-)=1011-amol•L-1,混合溶液呈中性,c(H+)=c(OH-),即10-1mol•L-1=1011-amol•L-1,a=12,
该温度下,水的离子积常数Kw=c(H+)•c(OH-)=10-12;故答案为:10-12;
③混合溶液的pH=lgc(H+)=$\frac{0.1{V}_{1}-0.01{V}_{2}}{{V}_{1}+{V}_{2}}$=2,解得V1:V2=2:9,故答案为:2:9.
点评 本题考查了溶液pH的简单计算,注意掌握溶液pH的计算方法,注意:离子积常数只与温度有关,与溶液酸碱性及浓度无关.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:多选题

| A. | 该反应可能为可逆反应 | |
| B. | 该反应可表示为2AB2?2AB3 | |
| C. | 单位时间内生成1 mol B2的同时生成2 mol AB2,这表明该反应已达平衡 | |
| D. | 该过程中,已反应的AB2占AB2总数的$\frac{2}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

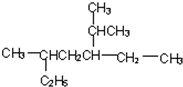 2,5-二甲基-3-乙基-庚烷
2,5-二甲基-3-乙基-庚烷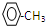 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$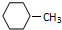 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用SO2漂白纸浆和草帽辫 | |
| B. | SO2具有强还原性,浓硫酸具有强氧化性,故浓硫酸不能用于干燥SO2气体 | |
| C. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 | |
| D. | Na2SO3与H2O2的反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③>①>②>④ | B. | ④>③>①>② | C. | ③>①=④>② | D. | ①=③=④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
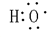 ;C22-(电子式)
;C22-(电子式)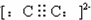 ;1,3-丁二烯(实验式)C2H3.
;1,3-丁二烯(实验式)C2H3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.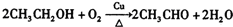 ..
..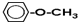 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电塑料是应用于电子工业的一种新型有机高分子材料 | |
| B. | 复合材料一般是以一种材料作基体,另一种材料作为增强体 | |
| C. | 高分子分离膜应用于食品工业中,可用子浓缩天然果汁、乳制品加工、酿造业等 | |
| D. | 合成高分子材料制成的人工器官都会受到人体的排斥作用,难以达到生物相容的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
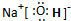 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com