
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:
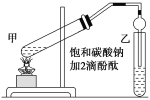
(1)连接好装置后,在加入试剂之前需要做的操作是________________________
(2)在甲试管(如图)中加入2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液,加入上述试剂的顺序为_____________________________________________
(3)甲试管中需加入少量__________以防止暴沸
(4)浓硫酸在反应中的作用是_______________________
(5)甲试管中反应的化学方程式___________________________________________
(6)乙中导管没有深入到液面下,原因是_____________________
(7)上述实验中饱和碳酸钠溶液的作用是:______(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(8)欲将乙试管中的物质分离开得到乙酸乙酯,采取的实验方法是_______;分离时,乙酸乙酯应该从仪器的________(填“下口放出” 或“上口倒出”)。
【答案】检验装置的气密性 先加入乙醇,再加入浓硫酸,最后加入乙酸(也可将浓硫酸放在最后) 碎瓷片(碎沸石) 催化剂 吸水剂 CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O 防倒吸 BC 分液 上口倒出
CH3COOC2H5 + H2O 防倒吸 BC 分液 上口倒出
【解析】
题给实验装置为乙酸乙酯的实验装置,试管甲中在浓硫酸作用下,乙醇和乙酸共热发生酯化反应生成乙酸乙酯和水,试管乙中盛有的是饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯。
(1)连接好装置后,在加入试剂之前需要做的操作是检验装置的气密性,故答案为:检验装置的气密性;
(2)浓硫酸的密度比乙醇大,在A试管中加入试剂的顺序是先在大试管中加入乙醇,然后慢慢向其中注入硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸,故答案为:先加入乙醇,再加入浓硫酸,最后加入乙酸(也可将浓硫酸放在最后);
(3)甲试管中在浓硫酸作用下,乙醇和乙酸共热发生酯化反应生成乙酸乙酯和水,为防止加热过程中暴沸,应加入碎瓷片(碎沸石)防止暴沸,故答案为:碎瓷片(碎沸石);
(4)浓硫酸在反应中起催化剂的作用,有利于反应的发生,该反应为可逆反应,浓硫酸起吸水剂的作用,减小生成物水的量,使酯化反应向生成乙酸乙酯的方向进行,提高乙酸乙酯的产率,故答案为:催化剂和吸水剂;
(5)试管甲中在浓硫酸作用下,乙醇和乙酸共热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O,故答案为:CH3COOH + C2H5OH
CH3COOC2H5 + H2O,故答案为:CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O;
CH3COOC2H5 + H2O;
(6)乙酸乙酯中混有乙醇和乙酸,二者易溶于水,导气管的下端伸入液面下会发生倒吸现象,故答案为:防倒吸;
(7) 试管乙中的饱和碳酸钠溶液能够中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;能够溶解挥发出来的乙醇;能够降低乙酸乙酯在水中的溶解度,便于分层得到酯,则BC正确,故答案为:BC;
(8)乙酸乙酯不溶于水,可用分液的方法将乙试管中的混合液分离开得到乙酸乙酯,因乙酸乙酯的密度小于水,分液时,下层水溶液从下口流出后,为防止发生污染,再将乙酸乙酯从分液漏斗的上口倒出,故答案为:分液;上口倒出。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 14gC2H4含有的单键数目为3NA
B. 99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C. 足量的Na与1molO2充分反应,转移的电子数目一定为2NA
D. 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)=c(Na+)>c(H+)=c(OH-)④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填编号)。
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则混合前两溶液的物质的量浓度大小关系为c(NaOH)________c(CH3COOH)(填“大于”“小于”或“等于”,下同).
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)________c(CH3COOH)(填“大于”“小于”或“等于”),混合后溶液中的各离子浓度的大小关系为_______________________。
(4)25℃时,现有浓度均为0.10 mol·L-1的2种溶液:① 醋酸、② 氢氧化钠。下列说法正确的是______(填字母)。
a.①中有CH3COO-发生水解,促进水的电离
b.②中由水电离出的c(H+)=1.0×10-13 mol·L-1
c.①和②等体积混合后:c(OH-)=c(H+)+c(CH3COOH)
d. ①和②混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
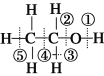
【题目】下列说法正确的是
A. 羟基与氢氧根离子有相同的化学式和电子式
B. 乙醇的官能团是—OH,可与NaOH溶液发生中和反应
C. 常温下,1 mol乙醇可与足量的Na反应生成11.2 L H2
D. 已知乙醇的结构式如图所示,则乙醇催化氧化时断裂的化学键为①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法 正确的是
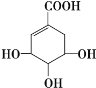
A. 分子式为C7H6O5
B. 分子中含有2种官能团
C. 可发生加成和酯化反应
D. 1mol莽草酸与足量的NaHCO3溶液反应可放出4molCO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下柠檬水的pH是3,纯碱溶液的pH是11,两溶液中的c(H+)浓度比为( )
A.3:11B.1:1C.10—3:10—11D.10—11:10—13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,这种有机物可能具有的性质是

①可以燃烧;②能使酸性KMnO4溶液褪色:
③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加聚反应
A. ①④B. 全部C. ①②③⑤D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅的说法不正确的是
A.晶体硅的导电性介于金属和绝缘体之间,是良好的半导体
B.加热到一定温度时,硅能与氯气、氧气等非金属反应
C.利用二氧化硅与C反应能制得粗硅
D.二氧化硅性质较稳定,常温下不与任何物质反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com