
【题目】煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又知:H2O(l)=H2O(g) ΔH2
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH=____________。
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________。
CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________。
A.v(H2)正=2v(CO)逆 B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变 D.CH3OCH3和H2O的体积之比不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g)![]() CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
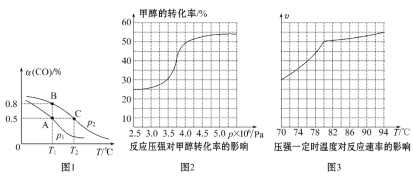
①合成甲醇的反应为______________(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为____________________。p1和p2的大小关系为___________。
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________L。
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为CH3OH(g)+CO(g)![]() HCOOCH3(g) ΔH2=-29.1 kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
HCOOCH3(g) ΔH2=-29.1 kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________(填“3.5×106Pa”“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是___________________。
【答案】(1)ΔH1-3ΔH2-2ΔH3;(2)c、d;(3)①放热;②KA=KB>KC,p1<p2;③7;(4)①4.0×106Pa;②高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低。
【解析】
试题分析:(1)盖斯定律,推出:△H=ΔH1-3ΔH2-2ΔH3;(2)a、用不同反应速率表示达到化学平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,v(H2)正化学反应向正反应方向进行,v(CO)逆化学反应向逆反应方向进行,且速率之比等于4:2=2:1,能说明达到化学平衡,故错误;b、平衡常数只受温度的影响,此容器是绝热容器,温度发生改变,因此当化学平衡常数不变时,说明反应达到平衡,故错误;c、根据密度的定义,组分都是气体,气体质量不变,是恒容状态,体积不变,因此密度不变,不能说明反应达到平衡,故正确;d、两者体积比始终相等,不能作为达到平衡的标志,故正确;(3)①随着温度升高,CO的转化率降低,平衡向逆反应方向进行,根据勒夏特列原理,正反应方向是放热反应;②化学平衡常数只受温度的影响,KA和KB温度相等,因此KA=KB,温度升高平衡向逆反应方向进行,平衡常数减少,因此KA=KB>KC,作等温线,增大压强平衡向正反应方向进行,CO的转化率增大,即p2>p1;
③CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始:10 20 0
变化: 5 10 5
平衡: 5 10 5
等温等压下,体积比等于物质的量之比,开始时的容器的体积为30×10/20L=15L,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始:10 20 0
变化: 8 16 8
平衡: 2 4 8
体积比等于物质的量之比,即14×15/30L=7L;(4)①根据图像,应选择压强为4.0×106Pa,5.0×106Pa,虽然甲醇的转化率大,但增加不多,如果选用5.0×106Pa,对设备的要求增加,成本提高,4.0×106Pa甲醇的转化率已经够大了,因此选择4.0×106Pa;②高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其他产物已略去):
![]()
下列说法不正确的是
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是盐酸,则X与Z可反应生成Y
C.若X是FeCl3溶液,则W可以是Zn或Al
D.若W是硝酸溶液, 则X与Z不能反应生成Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
A.a点时溶液中所含主要溶质为(NH4)2SO4
B.a→b段发生反应的离子方程式是SO42-+Ba2+===BaSO4↓
C.b点为最大沉淀量,对应的纵坐标值为0.02
D.c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池产生电流的本质原因是( )
A.原电池中溶液能电离出自由移动的离子
B.有两根导线将两个活泼性不同的电极连接
C.电极上进行的氧化还原反应的生成物为电子
D.电极上进行的氧化还原反应中发生了电子的转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示。回答下列问题:

(1)A装置的名称是____________;FeCO3在________中生成(填字母),该装置中发生的主要反应的离子方程式为____________________。
(2)实验时首先打开活塞3,关闭活塞2,其目的是___________________;然后再关闭活塞3,打开活塞2,其目的是_____________________。
Ⅱ.乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是常用的补铁剂。乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应。结束后,无需过滤,除去过量铁粉的反应方程式为_____________。
(4)从上述(3)所得溶液中获得乳酸亚铁晶体的方法是___________________、___________________、洗涤、干燥。
(5)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是_______________。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL,进行必要处理,用0.100 0 mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7 mL。滴定反应为Ce4++Fe2+====Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温常压下,1mol CH4的体积是22.4L
B. 1molFe在氯气中完全燃烧失去电子数为2NA
C. 用激光笔照射可鉴别Fe(OH)3胶体和FeCl3溶液
D. 用焰色反应可鉴别NaCl和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元酸H2A在水中存在以下电离:H2A==H++HA-,HA-![]() H++A2-,回答下列问题:
H++A2-,回答下列问题:
(1)Na2A溶液呈________性,理由是___________(用离子方程式表示)。
(2)NaHA溶液呈________性,理由是___________。
(3)0.1mol/L的NaHA溶液的PH=3,则Ka(HA-)=_____________。
(4)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至溶液中水的离子积常数Ka=c2(OH-),此时溶液呈___________性,V____________10 (填“<”“>”或“=”)c(K+)/c(Na+) ____________1(填“<”“>”或“=”),溶液中电荷守恒等式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来冶炼倭铅(即锌),其原理如图2。已知锌的熔点420℃、沸点906℃。则下列说法错误的是( )

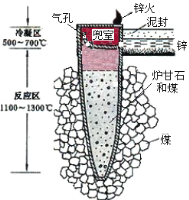
图1 图2
A.“泥封”的目的是为了防止得到的锌被氧化
B.“锌火”是锌蒸气和一氧化碳在空气的燃烧
C.冶炼时锌变为蒸气在兜室冷凝为固体
D.升炼倭铅过程包含分解反应和氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com