
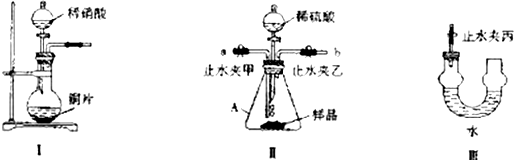
分析 (1)①仪器A为锥形瓶;
②利用I装置制备NO,Ⅱ装置中生成的气体与NO作用,根据颜色变化判断是否含有过氧化钠,由于装置中含有空气,会与NO反应生成二氧化氮,Ⅲ是收集NO,并除去NO中混有的二氧化氮,Ⅱ中通入氮气排尽装置中空气,装置Ⅲ中U形管中的膨大结构可以防止气流过快时液体被排出;
③若含有过氧化钠,Ⅱ中会反应生成氧气,氧气与NO反应生成红棕色的二氧化氮;
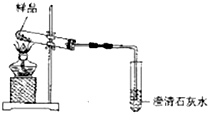
(2)碳酸氢钠分解得到二氧化碳、水蒸汽与过氧化钠反应,由于二氧化碳与氢氧化钠反应生成碳酸钠,可以看做二氧化碳先与过氧化钠反应,新制的澄清石灰水中有气泡产生,但始终未出现浑浊,说明没有二氧化碳生成,即碳元素全部存在于碳酸钠中,假设碳酸氢钠与过氧化钠恰好反应生成碳酸钠,根据碳酸钠中Na、C原子说明之比为2:1,可知碳酸氢钠与过氧化钠的物质的量之比为2:1,反应还生成水与氧气,结合原子守恒配平;
(3)利用检验碳酸根方法判断变质后的固体物质含有Na2CO3.
解答 解:(1)①由仪器结构特征,可知仪器A为锥形瓶,故答案为:锥形瓶;
②利用I装置制备NO,Ⅱ装置中生成的气体与NO作用,根据颜色变化判断是否含有过氧化钠,由于装置中含有空气,会与NO反应生成二氧化氮,Ⅲ是收集NO,并除去NO中混有的二氧化氮,反应方程式为:3NO2+H2O=2HNO3+NO,Ⅱ中通入氮气排尽装置中空气,装置Ⅲ中U形管中的膨大结构可以防止气流过快时液体被排出,
故答案为:收集NO,并除去NO中混有的二氧化氮;3NO2+H2O=2HNO3+NO;防止气流过快时液体被排出;
③若含有过氧化钠,Ⅱ中会反应生成氧气,氧气与NO反应生成二氧化氮,在装置Ⅲ中观察到的现象为:左侧管内气体由无色变为红棕色,
故答案为:左侧管内气体由无色变为红棕色;
(2)碳酸氢钠分解得到二氧化碳、水蒸汽与过氧化钠反应,由于二氧化碳与氢氧化钠反应生成碳酸钠,可以看做二氧化碳先与过氧化钠反应,新制的澄清石灰水中有气泡产生,但始终未出现浑浊,说明没有二氧化碳生成,即碳元素全部存在于碳酸钠中,假设碳酸氢钠与过氧化钠恰好反应生成碳酸钠,根据碳酸钠中Na、C原子说明之比为2:1,可知碳酸氢钠与过氧化钠的物质的量之比为2:1,反应还生成水与氧气,反应方程式为:4NaHCO3+2Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$4Na2CO3+2H2O+O2↑,n(NaHCO3):n(Na2O2)≤2时没有二氧化碳生成,
故答案为:4NaHCO3+2Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$4Na2CO3+2H2O+O2↑;
(3)设计实验证明其变质后的固体物质含有Na2CO3.
方法一:将样品配制成溶液,向溶液中滴加氯化钡溶液,有白色沉淀产生,
方法二:将样品配成溶液,向溶液中逐滴加入稀盐酸,开始无明显现象,一定时间后有气体产生,将气体通入澄清石灰水中,有白色沉淀产生,
故答案为:将样品配制成溶液,向溶液中滴加氯化钡溶液,有白色沉淀产生;将样品配成溶液,向溶液中逐滴加入稀盐酸,开始无明显现象,一定时间后有气体产生,将气体通入澄清石灰水中,有白色沉淀产生.
点评 本题考查探究实验方案设计、物质检验方案设计,关键是对原理的理解,题目综合较大,是对学生综合能力的考查,难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为2.8g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | |
| ⑥摇匀、装瓶、贴上标签 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电子式: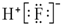 | |
| B. | H、D、T是氢元素的三种不同核素,互称同位素 | |
| C. | K+离子的结构示意图: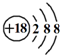 | |
| D. | 溴化钠的电子式: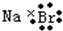 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | R的气态氢化物的水溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
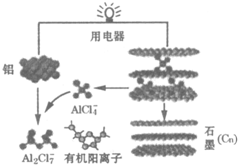
| A. | 放电时,有机阳离子向铝电极方向移动 | |
| B. | 充电时,铝电极连接外加电源的正极,石墨电极连接外加电源的负极 | |
| C. | 放电时负极的电极反应为:Al-3e-+7AlCl4-=4Al2Cl7- | |
| D. | 该电池的工作原理为:3Cn+4Al2Cl7-$?_{充电}^{放电}$3CnAlCl4+Al+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
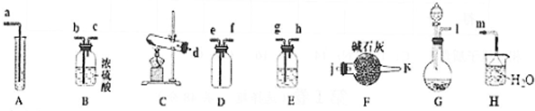
| 装置编号 | |||
| 装置中的试剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com