
| A、热稳定性:HF>HCl>HBr>HI |
| B、微粒半径:K+>Na+>Mg2+>Al3+ |
| C、酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
| D、沸点:HF>HCl>HBr>HI |


科目:高中化学 来源: 题型:
| A、常温下,含有石蕊的醋酸溶液加热颜色变深 |
| B、常温下,测得0.1 mol/L醋酸溶液的pH=4 |
| C、常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D、常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“84”消毒液的消毒原理是它具有较强的碱性 |
| B、臭氧、双氧水、次氯酸等消毒原理是它们具有较强的氧化性 |
| C、酒精消毒的原理是利用变性作用 |
| D、“84”消毒液的消毒原理是它具有较强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于6 | B、小于6 |
| C、等于6 | D、大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(NO3)2+H2SO4═Ba2SO4↓+2HNO3 |
| B、BaCl2+Na2SO4═Ba2SO4↓+NaCl |
| C、BaCO3+H2SO4═Ba2SO4↓+H2O+CO2 |
| D、BaCl2+H2SO4═Ba2SO4↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸与氢氧化钡反应:Ba2++SO42-=BaSO4↓ |
| B、氧化铜与盐酸反应:O2-+2 H+=H2O |
| C、钠与水反应:Na+2H2O=Na++2 OH-+H2↑ |
| D、澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
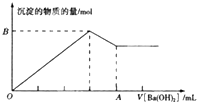 已知Ba[Al(OH)4]2可溶于水,图中表示的向100mL0.02mol.L-1KAl(SO4)2溶液中逐加入0.05mol.L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是( )
已知Ba[Al(OH)4]2可溶于水,图中表示的向100mL0.02mol.L-1KAl(SO4)2溶液中逐加入0.05mol.L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是( )| A、所价的Ba(OH)2溶液的c(OH-)=0.1mol.L- |
| B、A点的值是80mL |
| C、B点的值是0.005mol |
| D、当V[Ba(OH)2]时,生成沉淀的质量是0.699g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com