
| A. | 用氯化钠溶液做导电实验,灯泡发光:NaCl$\frac{\underline{\;通电\;}}{\;}$Na++Cl- | |
| B. | 氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 石灰水表面漂着的“白膜”可用醋酸溶解:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
分析 A.电离的条件为溶于水,不是通电;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.醋酸在离子反应中保留化学式;
D.反应生成硫酸钡、硫酸钠和水.
解答 解:A.用氯化钠溶液做导电实验,灯泡发光,发生电离为NaCl=Na++Cl-,故A错误;
B.氢氧化铁沉淀溶于氢碘酸中的离子反应为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B错误;
C.石灰水表面漂着的“白膜”可用醋酸溶解的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故C错误;
D.向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,正反应速率增大、逆反应速率减小 | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③④ | C. | ②③⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH4与4molCl2在光照下完全反应可生成1molCCl4 | |
| B. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| C. | 乙烯能被酸性高锰酸钾溶液氧化,而苯不易 | |
| D. | 1体积的C2H4完全燃烧需同温同压下3体积的O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
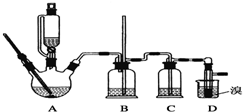
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com