
分析 (1)配制一定物质的量浓度的溶液,所需要的实验仪器主要有天平(含砝码)、药匙、烧杯、玻璃棒、容量瓶、胶头滴管等;
(2)高锰酸钾具有强氧化性,会腐蚀碱式滴定管中的橡皮管,应装在酸式滴定管中;
(3)在滴定过程中,目光应注视锥形瓶中溶液颜色的变化;滴定终点时溶液颜色无色变化为紫色且在30s内颜色不再恢复为原来颜色,证明反应达到终点;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)滴定管的刻度由上而下刻度增大,反应前后的两次读数分别为a mL和b mL,故消耗KMnO4溶液体积(b-a)mL,根据关系式2KMnO4~5H2C2O4计算25.0mL草酸溶液中c(H2C2O4).
解答 解:(1)实验①中为了配制准确浓度的草酸溶液100.00mL,所需要的实验仪器主要有天平(含砝码)、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管等,故还需要100mL容量瓶、胶头滴管;
故答案为:100mL容量瓶、胶头滴管;
(2)KMnO4溶液具有强氧化性,可以腐蚀碱式滴定管中的橡皮管,故KMnO4溶液应装在酸式滴定管中;
故答案为:酸式滴定管;
(3)在滴定过程中,目光应注视锥形瓶中溶液颜色的变化;KMnO4溶液呈紫色,草酸反应完毕,当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
故答案为:锥形瓶中溶液颜色的变化;当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色;
(4)①洗净的滴定管未用KMnO4标准液润洗,标准液浓度减小,造成v(标准)增大,据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大;
②锥形瓶用蒸馏水洗净之后,用草酸溶液润洗,待测液的物质的量偏大,造成v(标准)增大,据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大;
故答案为:偏大;偏大;
(5)滴定管的刻度由上而下刻度增大,反应前后的两次读数分别为a mL和b mL,故消耗KMnO4溶液体积(b-a)mL,n(KMnO4)=c mol•L-1×(b-a)×10-3L=c×(b-a)×10-3mol,根据关系式2KMnO4~5H2C2O4可知25.0mL草酸溶液中n(H2C2O4)=2.5×c×(b-a)×10-3mol,c(H2C2O4)=
$\frac{2.5×c×(b-a)×1{0}^{-3}mol}{25×1{0}^{-3}L}$=0.1c×(b-a)mol/L;
故答案为:0.1c×(b-a).
点评 本题考查氧化还原滴定,难度适中,注意掌握草酸含量的计算方法及滴定中的误差分析、实验操作方法即可解答.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
 )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得: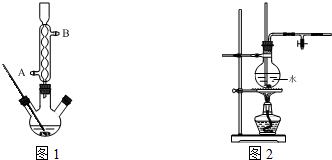
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ab | B. | cd | C. | ef | D. | gh |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=-485 kJ•mol - 1 | |
| B. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=+485 kJ•mol - 1 | |
| C. | 2H 2(g)+O 2(g)═2H 2O(g)△H=+485 kJ•mol - 1 | |
| D. | 2H 2(g)+O 2(g)═2H 2O(g)△H=-485 kJ•mol - 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
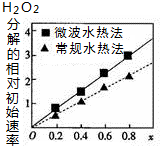 已知CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性,通常由两种不同方法制得.如图为二种方法制得的催化剂,在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线图.下列说法错误的是( )
已知CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性,通常由两种不同方法制得.如图为二种方法制得的催化剂,在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线图.下列说法错误的是( )| A. | 该催化剂中铁元素的化合价为+3价 | |
| B. | Co、Ni、Fe均为ⅧB族元素 | |
| C. | 由图中信息可知,Co2+、Ni2+两种离子中催化效果较好的是Co2+ | |
| D. | 由图中信息可知,微波水热法制取的催化剂活性更高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗 | |
| B. | 酸式滴定管在使用前未用待测液盐酸润洗 | |
| C. | 滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失 | |
| D. | 滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.| 实验 序号 | 消耗0.1000mol•L-1的 盐酸溶液的体积/mL | 待测氢氧化钠 溶液的体积/mL |
| 1 | 29.02 | 25.00 |
| 2 | 28.01 | 25.00 |
| 3 | 27.99 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 利用核磁共振氢谱可以鉴别1-丙醇和2-丙醇 | |
| C. | 溴苯水解后,滴加硝酸酸化的硝酸银溶液检验水解产物中的溴离子 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
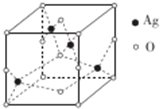 乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备:
乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备: ),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.
),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.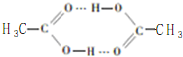
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com