
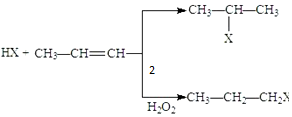
 (X为卤素原子)
(X为卤素原子)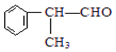 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$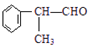
 .
.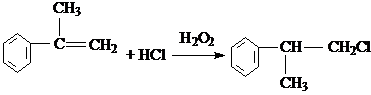 、2
、2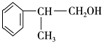 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.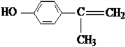 、
、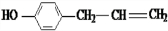 、
、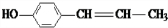 .
. 分析 E发生氧化反应生成 ,可推知E为
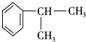
,可推知E为 ,由转化关系可知,苯与CH3CH=CH2发生加成反应生成A,A的核磁共振氢谱有五组峰,且峰面积之比为6:1:2:2:1,结合E的结构,可推知A为
,由转化关系可知,苯与CH3CH=CH2发生加成反应生成A,A的核磁共振氢谱有五组峰,且峰面积之比为6:1:2:2:1,结合E的结构,可推知A为 ,A与氯气在光照条件下发生侧链上的取代反应生成一氯代物B,B为
,A与氯气在光照条件下发生侧链上的取代反应生成一氯代物B,B为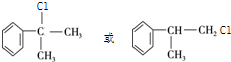 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成C为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成C为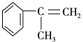 ,C在过氧化氢条件下与HCl发生取代反应生成D为
,C在过氧化氢条件下与HCl发生取代反应生成D为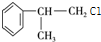 ,D在氢氧化钠水溶液、加热条件下发生水解反应生成E,据此解答.
,D在氢氧化钠水溶液、加热条件下发生水解反应生成E,据此解答.
解答 解:(1)由上述分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)反应①是苯与CH3CH=CH2发生加成反应生成 ,故答案为:加成反应;
,故答案为:加成反应;
(3)反应③是B在氢氧化钠醇溶液、加热条件下发生消去反应生成 ,故答案为:氢氧化钠醇溶液、加热;
,故答案为:氢氧化钠醇溶液、加热;
(4)根据以上分析,反应④为C在过氧化氢条件下与HCl发生取代反应生成D,化学方程式为: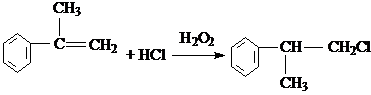
 ,化学方程式为2
,化学方程式为2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O,
+2H2O,
故答案为: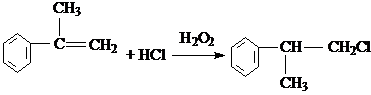
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;
(5)这种香料( )具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色,含有酚羟基,②分子中有苯环,且苯环上的一溴代物有两种,应含有2个侧链且处于对位,③在一定条件下,自身能形成高聚物,含有碳碳双键,符合上述条件的物质可能的结构简式为:
)具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色,含有酚羟基,②分子中有苯环,且苯环上的一溴代物有两种,应含有2个侧链且处于对位,③在一定条件下,自身能形成高聚物,含有碳碳双键,符合上述条件的物质可能的结构简式为: 、
、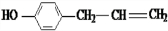 、
、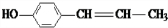 ,
,
故答案为: 、
、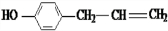 、
、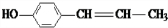 .
.
点评 本题考查有机物推断与合成,需要学生对给予的信息进行利用,较好的考查学生的自学能力与知识迁移应用,注意根据有机物的结构进行推断,侧重考查学生的分析推理能力,需要学生舍利子核外官能团的性质与转化,难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
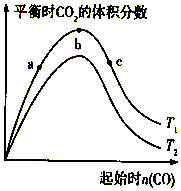 燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )
燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )| A. | T1比T2高 | |
| B. | b点SO2转化率最高 | |
| C. | b点后曲线下降是因CO体积分数升高 | |
| D. | 减小压强可提高CO、SO2转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).
如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
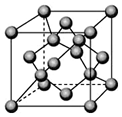 已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:
已知A、B、C、D都是元素周期表中前36号的元素.A元素的一种核素没有中子.B的基态原子核外电子有9种不同的运动状态;C元素是无机非金属材料的主角,它的单质可以用作电脑芯片;D元素是地壳中含量第二的金属元素.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用二氧化钛作催化剂使水快速分解的同时放出大量热 | |
| B. | 该过程涉及到的反应为氧化还原反应 | |
| C. | 该反应的原理是:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2+O2 | |
| D. | 每产生氢气44.8L,转移电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 | |
| B. | 向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,可推知同温下Ksp(ZnS)<Ksp(CuS) | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应方程式为2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq) | |
| D. | 向2mL浓度均为1.2mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-}C)•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$不变 | |
| B. | 通入CO2,溶液pH增大 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 加入NaOH固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com