
| A�� | ������ˮԭ�����漰��ѧ�仯 | |
| B�� | �ִ��Ƽ��Ѿ��ܹ��ĵ�����ġ���Ƭ����ֱ�۵�֤ʵ��ˮ���Ӽ�������һ��ˮ�����е���ԭ������һ��ˮ�����е���ԭ�Ӽ��γɵĻ�ѧ�� | |
| C�� | ��ʳƷ���з���ʢ�й轺�����۵���С�����ɷ�ֹʳ���ܳ����������� | |
| D�� | ������ͭ�Ƴɡ�����ͭ��ʱ�����зdz�ǿ�Ļ�ѧ���ԣ��ڿ����п���ȼ�գ�˵��������ͭ���Ļ�ԭ�Ա�ͭƬ��ǿ |
���� A����������Һ��ˮ��Ϊ������������Ӷ��ܾ�ˮ��
B������Ƿ��Ӽ���������
C���轺��һ�ָ������������ǿ��ԭ�ԣ�
D������ͭҲ��ͭ����ͭƬд��ѧ������ȫ��ͬ��
��� �⣺A����������Һ��ˮ��Ϊ������������Ӷ��ܾ�ˮ���������ˮ���ǻ�ѧ��Ӧ����A����
B������Ƿ��Ӽ��������������ǻ�ѧ������B����
C���轺��һ�ָ�������ɷ�ֹʳ���ܳ�����������ǿ��ԭ�ԣ��ܷ�ֹ�����������ʣ���C��ȷ��
D������ͭҲ��ͭ����ͭƬд��ѧ������ȫ��ͬ�������ڿ�����С���ʷ�Ӧ���ʽϿ죬��D����
��ѡC��
���� ���⿼��������ˮ��ͻ�ѧ�����������е�Ӧ�ã��ѶȲ���Ӧע���������ͭ����ͭ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ�� ���� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ� ��t2-t1��/�� | �¶Ȳ�ƽ��ֵ�� | ||
| H2SO4 | NaOH | ƽ��ֵ | ||||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͭ���ҹ�ʹ������ĺϽ� | |
| B�� | ���ά��ͨѶ�����������ŵ㣬���¸�ʴ������Ҳ�ܲ����� | |
| C�� | ���½ṹ�մɱȽ������Ͼ��������ŵ㣬�粻���������ܶ�С���ŵ� | |
| D�� | ���ά������ͨѶ�⣬����������ҽ�ơ���Ϣ����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5�� | B�� | 6�� | C�� | 7�� | D�� | 8�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
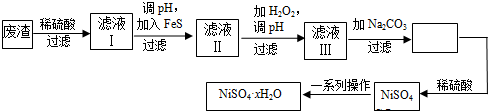
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com