
现有以下物质:①KCI晶体②食盐水③液态的醋酸④I2⑤BaSO4固体⑥蔗糖(C12H22O11 )⑦酒精(C2H5OH)⑧熔融的NaOH⑨K2O⑩SO2。请回答下列问题:
(1)以上物质中能导电的是_________________(用序号)。
(2)以上物质属于电解质的是_________________(用序号)。
(3)以上物质中属于非电解质的是_________________(用序号)。
(4)从②溶液中得到氯化钠固体,应选择下列装置中的______________(填代表装置图的字母,下同);分离④与⑦的混合液,应选择下列装置中的________________。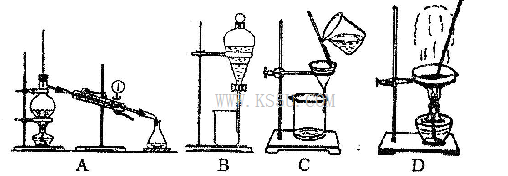
(5)请写出③和⑧中两种物质的溶液混合后发生反应的离子方程式:________________________________________________________________________.
(6)在标准状况下,__________L⑩与34. 2g⑥中含有相同的氧原子数。
(1)②⑧
(2)①③⑤⑧⑨
(3)⑥⑦⑩
(4)D A
(5)CH3COOH+OH-=CH3COO-+H2O
(6)12.32L
解析试题分析:(1)溶液中存在自由移动的离子或者是固体中存在自由移动的电子都可以导电,所给题中只有②⑧符合题意。
(2)电解质是指在水溶液中或者是在熔融状态下能够导电的化合物,②是混合物,错误,④是单质,错误,⑥⑦⑩是典型的非电解质,错误;只能选:①③⑤⑧⑨
(3)非电解质是指在水溶液中和熔融状态下能够不能够导电的化合物,⑥⑦⑩
(4)从②溶液中得到氯化钠固体,应选择下列装置中的蒸发装置:D;分离④与⑦的混合液,应选择下列装置中的蒸镏装置:A
(5)醋酸是弱电解质,不能拆开成离子:CH3COOH+OH-=CH3COO-+H2O
(6)34. 2g⑥(C12H22O11 )是0.1mol,其中含有氧原子是1.1mol,含同样多的二氧化硫是0.55mol,换算成标况下的体积为:12.32L
考点:电解质分类、化学实验基本操作。


科目:高中化学 来源: 题型:填空题
进行污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式 ,
萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是 。
(2)如图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。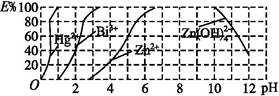
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH= 。
②当调节pH=2时,铋(Bi)的存在形式有 ,其物质的量之比为 。
③萃取到CCl4中的Zn(HDz)2分液后,加入足量NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
(3)污水中的亚汞离子(H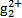 )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H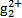 生成硫酸汞,写出该反应的化学方程式: 。
生成硫酸汞,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铜矿(CuFeS2)是制铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、
。
(不必配平,每空1分)。
(4)利用黄铜矿冶炼铜产生的炉渣(Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答以下问题:选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。证明炉渣中含有的实验现象为
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红(Fe2O3)和氧化铜。(已知铜能溶解在稀硝酸中生成硝酸铜溶液)
请填写下面空白:
(1)图中标号处需加入的相应物质分别是(填化学式)① ②
③ ④ ;
(2)A处固体成分为 (填化学式)
(3)写出⑤处反应的化学方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按图的装置连接好仪器,先在烧杯中加入20mL左右的Ba(OH)2溶液,接通电源后,逐渐滴加稀硫酸至过量。
(1)当逐渐滴加稀硫酸时,烧杯中观察到的现象是: 。
(2)灯泡的现象是: ;原因是: 。
(3)发生反应的离子方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某河道两旁有甲、乙两个化工厂。它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
(1)经测定甲厂的废水明显呈酸性,故乙厂废水中所含的三种离子应该是 。
(2)如果要回收废水中的金属银,可以在废水中加入过量的一种常见金属,反应后的溶液中只含一种金属阳离子,过滤所得固体的成分是 ,要进一步分离出银,方法是 。
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出生成红褐色沉淀的离子方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、Fe2+、AlO2-、CO32-、NH4+、SO42-、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
| 实验内容以及现象 | 结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 | N中不含 离子 |
| ② | 确定M溶液中含有Na+,不含K+ |
 ③用pH试纸检测M溶液,pH试纸呈蓝色 ③用pH试纸检测M溶液,pH试纸呈蓝色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
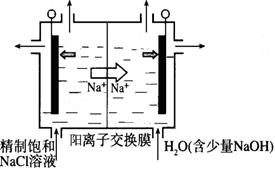
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
① 浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com