
| A、固体电解质中O2-向正极移动,向外电路释放电子的电极是负极 |
| B、这个电池负极发生的反应是:C4H10+13O2--26e-═4CO2+5H2O |
| C、这种电池放电时发生的化学反应方程式为:2C4H10+13O2═8CO2+10H2O |
| D、人们追求燃料电池氧化汽油,而不在内燃机里燃烧汽油产生动力的主要原因是燃料电池具有较高的能量利用率 |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
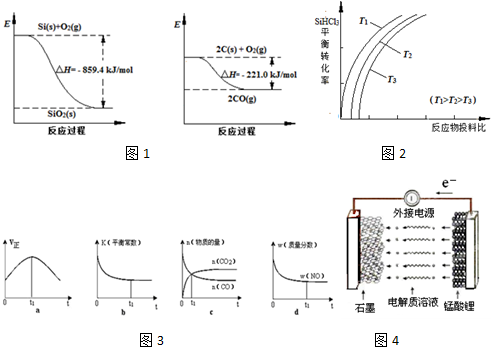
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
| 催化剂 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、采用结晶的方法除去氯化钠溶液中的泥沙 |
| B、用酒精萃取溴水中的溴单质 |
| C、用蒸馏的方法分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃) |
| D、用过滤的方法从含有少量氯化钠溶液的硝酸钾溶液中提取硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②③ |
| B、只有②③⑤ |
| C、只有①②③④ |
| D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-丙基戊烷 |
B、已知C-C键可以绕键轴自由旋转,结构简式为 ,分子中至少有7个碳原子处于同一直线上 ,分子中至少有7个碳原子处于同一直线上 |
C、 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O5Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O5Na4 |
D、肌醇  与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
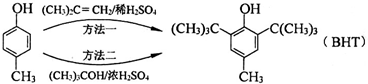
A、 与BHT为同系物 与BHT为同系物 |
B、 能发生氧化反应 能发生氧化反应 |
| C、BHT不能与NaHCO3溶液反应生成CO2 |
| D、两种方法的反应类型都是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
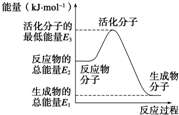 已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1下列说法正确的是( )
已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1下列说法正确的是( )| A、反应中的能量变化如图所示,则△H=E1-E3 |
| B、若加入催化剂,将改变反应历程,从而改变△H |
| C、温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D、若保持温度和容器体积不变,充入氦气,则压强增大,化学反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com