
| 化合物 | PbSO4 | PbCO3 |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 |
| Ksp | 1.82×10-8 | 1.46×10-13 |
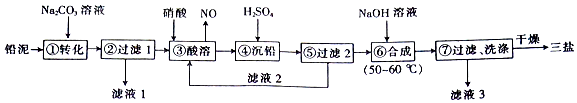
分析 以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐:向铅泥中加Na2CO3溶液是将PbSO4转化成PbCO3,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3,Pb、PbO和PbCO3在硝酸的作用下反应:3Pb+8HNO3=Pb(NO3)2+2NO↑+4H2O、PbCO3+2HNO3=Pb(NO3)2+CO2↑+H2O、PbO+2HNO3=Pb(NO3)2+2H2O,均转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,过滤的滤液为HNO3,可循环利用,向硫酸铅中加入氢氧化钠合成三盐和硫酸钠,4PbSO4+6NaOH$\frac{\underline{\;50~60℃\;}}{\;}$3PbO•PbSO4•H2O+3Na2SO4+2H2O滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,据此分析解答.
解答 解:(l)步骤①向铅泥中加Na2CO3溶液,由表可知PbCO3的溶解度小于PbSO4的溶解度,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),则可将PbSO4转化成PbCO3,所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3;
故答案为:将PbSO4转化为PbCO3,提高铅的利用率;Na2SO4;
(2)酸溶时,为提高酸溶速率,可采取的措施是适当升温(或适当增大硝酸浓度或减小沉淀粒径等);铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为:3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;
故答案为:适当升温(或适当增大硝酸浓度或减小沉淀粒径等);3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;(3)Pb、PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,HNO3可循环利用,若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,已知Ksp(PbSO4)=1.82×10-8,则此时c(SO42-)=$\frac{1.82×1{0}^{-8}}{1.82×1{0}^{-5}}$mol/L=1.00×10-3mol/L;
故答案为:HNO3;1.00×10-3;
(4)步骤⑦沉淀表面附着硫酸根离子,检验沉淀是否洗净,检测其洗涤液是否含有硫酸根离子即可,方法为:取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全;
故答案为:取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全;
(5)从流程看,硫酸铅和氢氧化钠反应生成三盐基硫酸铅和硫酸钠,反应方程式为:4PbSO4+6NaOH$\frac{\underline{\;50~60℃\;}}{\;}$3PbO•PbSO4•H2O+3Na2SO4+2H2O,
若得到纯净干燥的三盐99.0t,则其中铅元素的质量为:$\frac{828}{990}×99.0t$=82.8t,设铅泥中铅元素的质量分数为w,则200.0t铅泥中铅元素为200×w,铅泥中的铅元素有80%转化为三盐,有200×w×80%=82.8,解得x=51.75%;
故答案为:4PbSO4+6NaOH$\frac{\underline{\;50~60℃\;}}{\;}$3PbO•PbSO4•H2O+3Na2SO4+2H2O;51.75%.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 23gNa与O2完全反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| B. | 88.0g14CO2与14N2O的混合物中所含中子数为44NA | |
| C. | 0.1L,l.0mol/L的NaAlO2水溶液中含有的氧原子数为0.2NA | |
| D. | 室温下,将1mol铁片投入到0.5L,18.4mol/L的硫酸中,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量Mg与2.8gN2完全反应后失去0.2NA电子 | |
| B. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| C. | 常温常压下,2.8gC2H4含有共用电子对的数目为0.6NA | |
| D. | 16gO2含有NA个18O原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素可以形成离子化合物 | |
| B. | 元素X 和W之间不可能形成二元化合物 | |
| C. | 元素Y的简单气态氧化物的热稳定性比Z的弱 | |
| D. | 元素Y、Z、W中,元素W的简单离子的半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 实际应用 |
| A | 蛋白质受热变性 | 用高温加热的方法杀死流感病毒 |
| B | 明矾溶液显酸性 | 用明矾溶液清除铜镜表面的铜锈 |
| C | Na2CO3溶液显碱性 | 用热的纯碱溶液洗去油污 |
| D | P2O5具有吸水性 | 用P2O5干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
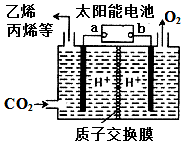
| A. | a电极为太阳能电池的正极 | |
| B. | 产生丙烯的电极反应式为:3CO2+18H++18e-═CH3CH=CH2+6H2O | |
| C. | 装置中每转移2e-,理论上有2molH+通过质子交换膜从左向右扩散 | |
| D. | 太阳能电池的原理与原电池的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24:30 | B. | 60:24 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该磁黄铁矿中FexS的x=0.425 | |
| B. | 生成的H2S气体在标准状况下的体积为2.24L | |
| C. | 100mL的盐酸中HCl物质的量浓度为8.5mol/L | |
| D. | 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4项 | B. | 3项 | C. | 2项 | D. | 1项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com