
 ),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 1molN4气体完全转变为N2将放出882kJ热量 | |
| B. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| C. | N4属于一种新型的化合物 | |
| D. | 14N与15N化学性质不相同 |
分析 A.根据化学键断裂要吸收热量,形成化学键要放出热量,根据题中数据计算出1molN4转变成N2放出的热量;
B.同位素是质子数相同,中子数不同的原子;同素异形体是同种元素形成的不同单质;
C.化合物是由不同种元素组成的纯净物,单质是由同种元素组成的纯净物;
D.同位素化学性质相同.
解答 解:A.1molN4气体中含有0.6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故A正确;
B.14N2与15N2都是单质不是同位素,N4与N2是同种元素形成的不同单质,则N4与N2互为同素异形体,故B错误;
C.N4由N元素组成的纯净物,是一种单质,故C错误;
D.14N与15N互为同位数,化学性质相同,故D错误;
故选A.
点评 本题考查较为综合,涉及物质的组成和分类、同位素和同素异形体的辨析、以及反应热的计算等问题,题目难度不大,注意基础知识的把握,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:多选题

| A. | 滤液A中阳离子为Fe2+、H+ | B. | 样品中金属Fe的质量为2.14g | ||
| C. | 样品中CuO的质量为4.0g | D. | V=448 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
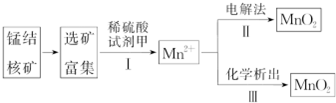
| 实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
| Ⅰ | 5% | 2.0g | 20℃ | |
| Ⅱ | 5% | 1.0g | 20℃ | |
| Ⅲ | 10% | 1.0g | 20℃ | |
| Ⅳ | ω | 2.0g | 30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
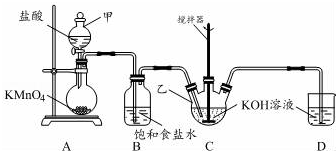 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
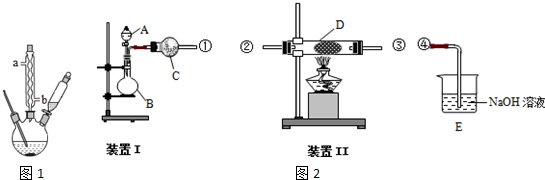
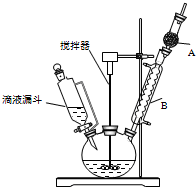 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,则有反应HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3kJ•mol-1 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 已知氧气较臭氧稳定,则3O2(g)═2O3(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

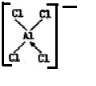 ,[AlCl4]的立体构型名称为正四面体形.
,[AlCl4]的立体构型名称为正四面体形.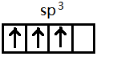 ,铍与铝元素性质相近的原因是Be与Al的电负性相近.
,铍与铝元素性质相近的原因是Be与Al的电负性相近.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
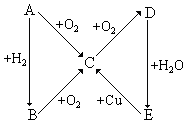 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com