
1.01×105Pa大气压150℃时将体积为8L的某二烯烃和适量氧气的混合气体点燃使之完全反应,再恢复到原来温度和压强时,测得生成的混合气体体积为9L,则此二烯烃分子中的碳原子数为
[ ]
A.4 B.5 C.6 D.8
科目:高中化学 来源: 题型:阅读理解
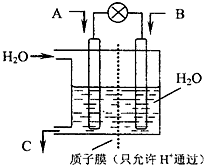 (2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
(2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.| 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| pH | 3.0 | 4.0 | 5.0 | 6.0 |
| t/min | ||||
| T/℃ | ||||
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
| 0.012ac |
| V |
| 0.012ac |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 烃的化学式 | n(CO)/n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(12分)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+Os(g)=3Ag2O(s);
△H= 一235.8kJ·mol-1,已知2Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ·mol-1,则O3转化为O2的热化学方程式为 。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下图所示。

pH增大能加速O3分解,表明对O3分解起催化作用的是 。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,其电极反应式为 ;阴极附近的氧气则生成过氧化氢,其电极反应式为 。
(4)为测定大气中臭氧(03)含量,将0℃、1.01 × 105Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol·L。的Na2S2O2溶液进行滴定恰好到达终点。
①O3与Ⅺ溶液反应生成两种单质,则反应的化学方程式 。
②空气中臭氧的体积分数为 。
(已知:2Na2S2+12=Na2S406+2NaI)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com