
| A. | Q3>Q2>Q1 | B. | Q1>Q3>Q2 | C. | Q1=Q2=Q3 | D. | Q2>Q3>Q1 |
科目:高中化学 来源: 题型:选择题
| A. | 10mL pH=13的氨水与10mL pH=l的盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | l0 mL0.1 mol/L NH4Cl溶液与5mL 0.2mol/LNaOH溶液混合:c(Cl-)=c(Na+)>c(OH-)>(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液与10 mL pH=13的NaOH溶液混合:c(CH3COO-)=c(Na+)>c(OH-)>c(H+) | |
| D. | l0 mL 0.5mol/L CH3COONa溶液与6mL pH=0的盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )
常温下,向100mL 0.01mol•L-1的HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )| A. | HA为弱酸 | |
| B. | 常温下,MA溶液的pH>7 | |
| C. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| D. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在家用燃煤中加人适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 利用太阳能、潮汐能、风力发电,以获取清洁能源 | |
| C. | 采用纳米二氧化钛光触媒技术.将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 大量排放SO2,NO2或CO2都会导致酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①Ⅰ | B. | ②Ⅱ | C. | ③Ⅲ | D. | ④Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
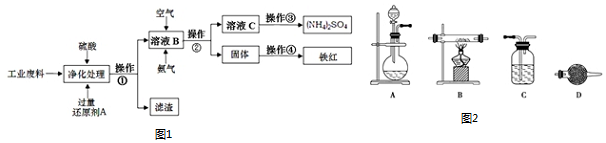
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com